Осмиум тетроксид
| |||

| |||
Претпочитано име по МСЧПХ: Осмиум тетраоксид | |||
| Систематско име | Тетраоксоосмиум | ||
Други називи Осмиум(VIII) оксид | |||
| Назнаки | |||
|---|---|---|---|
| 20816-12-0 | |||
| ChEBI | CHEBI:88215 | ||
| ChemSpider | 28158 | ||
| EC-број | 244-058-7 | ||
| |||
| 3Д-модел (Jmol) | Слика | ||
| MeSH | Осмиум+тетроксид | ||
| PubChem | 30318 | ||
| RTECS-бр. | RN1140000 | ||
| |||
| UNII | P40W033BGM | ||
| ОН-бр. | UN 2471 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Бело испарливо цврсто соединение | ||
| Мирис | Остро, слично на хлор | ||
| Густина | 4.9 g/cm3[1] | ||
| Точка на топење | |||
| Точка на вриење | |||
| 5.70 g/100 mL (10 °C) 6.23 g/100 mL (25 °C) | |||
| Растворливост | Растворлив во повеќе органски растворувачи, амониум хидроксид, фосфор оксихлорид | ||
| Растворливост во CCl4 | 375 g/100 mL | ||
| Парен притисок | 7 mmHg (20 °C)[2] | ||
| Структура | |||
| Кристална структура | Моноклинична, mS20 | ||
| C2/c | |||
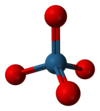
| Геометрија на молекулата | тетраедарска | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми
|
 
| ||
Сигнални зборови
|
Опасно | ||
Изјави за опасност
|
H300, H310, H314, H330 | ||
Изјави за претпазливост
|
P260, P262, P264, P270, P271, P280, P284, P301+P310, P301+P330+P331, P302+P350, P303+P361+P353, P304+P340, P305+P351+P338, P310, P320, P321, P322, P330, P361, P363, P403+P233, P405, P501 | ||
| NFPA 704 | |||
| Смртоносна доза или концентрација: | |||
LCLo (најниска објавена)
|
1316 mg/m3 (зајак, 30 min) 423 mg/m3 (стаорец, 4 hr) 423 mg/m3 (глушец, 4 hr)[3] | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива)
|
TWA 0.002 mg/m3[2] | ||
REL (препорачана)
|
TWA 0.002 mg/m3 (0.0002 ppm) ST 0.006 mg/m3 (0.0006 ppm)[2] | ||
IDLH (непосредна опасност)
|
1 mg/m3[2] | ||
| Безбедносен лист | ICSC 0528 | ||
| Слични супстанци | |||
| Други катјони | Рутениум тетроксид | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Осмиум тетроксид (или осмиум(VIII) оксид) е хемиско соединение со формулата OsO4. Соединението е значајно за неговите многубројни намени и покрај неговата токсичност и реткост на осмиумот. Исто така, има голем број на необични својства, една од нив е дека цврстото е испарливо. Соединението е безбојно, но повеќето примероци изгледаат жолти.[4] Ова најверојатно се должи на присуството на нечистотија OsO2, која има жолто-кафеава боја.[5] Во биологијата, неговата особина да се врзува за липидите го направила широко употребувана дамка во електронската микроскопија.
Физички својства[уреди | уреди извор]
Осмиум(VIII) оксид формира моноклинични кристали.[6][7] Има карактеристичен остар мирис сличен на хлор. Името на елементот осмиум е изведено од osme, грчки за мирис. OsO4 iе испарлив: се сублимира на собна температура. Растворлив е во широк спектар на органски растворувачи. Исто така е умерено растворлив во вода, со која реагира реверзибилно за да формира осминска киселина (види подолу).[8] Чистиот осмиум(VIII) оксид е веројатно безбоен[9] и се претпоставува дека неговата жолта нијанса се должи на нечистотиите од осмиум диоксид (OsO2).[10] TМолекулата на осмиум тетрооксид е тетраедрална и затоа неполарна. Оваа неполарност му помага на OsO4 да навлезе во наелектризираните клеточни мембрани. OsO4 е 518 пати повеќе растворлив во јаглерод тетрахлорид отколку во вода.
Структура и електронска конфигурација[уреди | уреди извор]
Осмиум во OsO4 има оксидационен број VIII; сепак, металот нема соодветен полнеж од 8+ бидејќи врската во соединението е во голема мера ковалентна по карактер (енергијата на јонизација потребна за да се произведе формално до полнеж од 8+, исто така, далеку ги надминува енергиите достапни во нормалните хемиски реакции). Атомот на осмиум покажува двојни врски со четирите оксидни лиганди, што резултира со комплекс од 16 електрони. Ова е изоелектронски со перманганат и хромат јони.
Синтеза[уреди | уреди извор]
OsO4 се формира бавно кога прашокот на осмиум реагира со O2 на амбиентална температура. Реакцијата на масовната цврстина бара загревање до 400 °C.[11]
Реакции[уреди | уреди извор]
Оксидација на алкени[уреди | уреди извор]
Алкените се додаваат во OsO4 за да дадат диолат видови кои се хидролизираат во цис-диоли. Нето-процесот се нарекува дихидроксилација. Ова продолжува преку [3 + 2] реакција на циклоадиција помеѓу OsO4 и алкен за да се формира среден осматен естер кој брзо се хидролизира за да го добие вициналниот диол. Како што атомите на кислород се додаваат во усогласен чекор, добиената стереохемија е cis.
OsO4е скап и многу токсичен, што го прави непривлечен реагенс за употреба во стехиометриски количини. Сепак, неговите реакции се каталитички со додавање на реоксиданти за реоксидација на нус-производот Os(VI) назад во Os(VIII). Типични реагенси вклучуваат H2O2 (Milas хидроксилација), N-метилморфолин N-оксид (Upjohn дихидроксилација) и K3Fe(CN)6/вода. Овие реоксиданти не реагираат сами со алкените. Други соединенија на осмиум може да се користат како катализатори, вклучувајќи соли на осмат(VI) соли ([OsO2(OH)4)]2−, и осмиум трихлорид хидрат (OsCl3·xH2O). Овие видови оксидираат до осмиум (VIII) во присуство на такви оксиданти.[12]
Луисовите бази како што се терциерните амини и пиридините ја зголемуваат стапката на дихидроксилација. Ова „забрзување на лигандот“ настанува преку формирање на аддукт OsO4L, кој побрзо се додава на алкенот. Ако аминот е хирален, тогаш дихидроксилацијата може да продолжи со енантиоселективност (види Sharpless асиметрична дихидроксилација).[13] OsO4 не реагира со повеќето јаглени хидрати.[14]
Процесот може да се прошири за да се добијат два алдехиди во оксидацијата Lemieux-Johnson, која користи перјодат за да постигне расцеп на диол и да го регенерира каталитичкото оптоварување на OsO4. Овој процес е еквивалентен на оној на озонолизата.
Координативна хемија[уреди | уреди извор]

OsO4 е Луисова киселина и благ оксиданс. Тој реагира со алкален воден раствор за да го добие перосматниот анјон OsO4(OH)2−
2.[16] Овој вид лесно се сведува на осмат анјон, OsO2(OH)2−
4.
Кога Луисовата база е амин, се формираат и адукти. Така OsO4 може да се складира во форма на осмет, во кој OsO4 е комплексен со хексамин. Осметот може да се раствори во тетрахидрофуран (THF) и да се разреди во воден пуфер раствор за да се добие разреден (0,25%) работен раствор на OsO4.[17]
Со tert-BuNH2, се добива имидо дериват:
- OsO4 + Me3CNH2 → OsO3(NCMe3) + H2O
Слично, со NH3 се добива нитридо комплекс:
- OsO4 + NH3 + KOH → K[Os(N)O3] + 2 H2O
[Os(N)O3]− анјонот е изоелектичен и изоструктурен со OsO4.
OsO4 е многу растворлив во tert-бутил алкохол. Во раствор, тој лесно се редуцира со водород до метал на осмиум. Суспендираниот метал на осмиум може да се користи за катализирање на хидрогенизација на широк спектар на органски хемикалии кои содржат двојни или тројни врски.
- OsO4 + 4 H2 → Os + 4 H2O
OsO4 се подложува на „редуктивна карбонилација“ со јаглерод моноксид во метанол на 400 К и 200 sbar за да се произведе триаголниот кластер Os3(CO)12:
- 3 OsO4 + 24 CO → Os3(CO)12 + 12 CO2[11]
Оксофлуориди[уреди | уреди извор]
Осмиумот формира неколку оксофлуориди, од кои сите се многу чувствителни на влага. Виолетова cis-OsO2F4 се формира на 77 K во безводен раствор на HF:[18]
- OsO4 + 2 KrF2 → cis-OsO2F4 + 2 Kr + O2
OsO4 исо така реагира со F2 и формира жолт OsO3F2:[19]
- 2 OsO4 + 2 F2 → 2 OsO3F2 + O2
OsO4 реагира еквивалентно со [Me4N]F на 298 K и со 2 еквиваленти на 253 K:[11]
- OsO4 + [Me4N]F → [Me4N][OsO4F]
- OsO4 + 2 [Me4N]F → [Me4N]2[cis-OsO4F2]
Употреба[уреди | уреди извор]
Органска синтеза[уреди | уреди извор]
Во органската синтеза, OsO4 е широко користен за оксидација на алкените во соседни диоли, додавајќи две хидроксилни групи на истата страна (syn адиција). Видете реакција и механизам погоре. Оваа реакција е направена и каталитичка (Upjohn дихидроксилација) и асиметрична (Sharpless асиметрична дихидроксилација).
Осмиум(VIII) оксидот исто така се користи во каталитички количества при оксиаминацијата на Sharpless за да се добијат вицинални амино-алкохоли.
Во комбинација со натриум перjодат, OsO4 се користи за оксидативно расцепување на алкените (Lemieux-Johnson оксидација) кога периодатот служи и за расцепување на диолот формиран со дихидроксилација и за реоксидација на OsO3 назад во OsO4. T Нето трансформацијата е идентична со онаа што се создава со озонолиза. Подолу е пример од вкупната синтеза на Isosteviol.[20]
Биолошко боење[уреди | уреди извор]
OsO4 OsO4 е широко користен агенс за боење што се користи во преносната електронска микроскопија (TEM) за да обезбеди контраст на сликата.[21] TОвој метод на боење може да биде познат и во литературата како метод OTO[22][23] Овој метод на боење може да биде познат и во литературата како метод OTO.[24] Како липидна дамка, исто така е корисна за скенирање на електронска микроскопија (SEM) како алтернатива на распрсканата обвивка. Вградува тежок метал директно во клеточните мембрани, создавајќи висока стапка на расејување на електрони без потреба од обложување на мембраната со слој од метал, што може да ги прикрие деталите на клеточната мембрана. При боење на плазматската мембрана, осмиум(VIII) оксидот ги врзува областите на главата на фосфолипидите, со што се создава контраст со соседната протоплазма (цитоплазма). Дополнително, осмиум(VIII) оксид се користи и за фиксирање на биолошки примероци во врска со HgCl2. Неговите способности за брзо убивање се користат за брзо убивање живи примероци како што се протозои. OsO4 стабилизира многу белковини со тоа што ги трансформира во гелови без да ги уништи структурните одлики. Ткивните белковини кои се стабилизираат со OsO4 не се коагулираат со алкохол за време на дехидрација.[14] Осмиум(VIII) оксидот се користи и како дамка за липиди во оптичката микроскопија. OsO4 исто така ја обојува човечката рожница (види безбедност).

Боење на полимер[уреди | уреди извор]
Исто така, се користи за преференцијално боење на кополимери, а најпознат пример се блок кополимерите каде што една фаза може да се обои за да се покаже микроструктурата на материјалот. На пример, блок кополимерите на стирен-бутадиен имаат централен полибутадиенски ланец со полистиренски крајни капачиња. Кога се третира со OsO4, матрицата на бутадиен реагира преференцијално и така го апсорбира оксидот. Присуството на тежок метал е доволно за да го блокира електронскиот сноп, така што полистиренските домени се гледаат јасно во тенки филмови во ТЕМ.
Рафинирање на осмиумска руда[уреди | уреди извор]
OsO4 е посредник во екстракцијата на осмиумот од неговите руди. Остатоците што содржат осмиум се третираат со натриум пероксид (Na2O2) формирајќи Na2[OsO4(OH)2], кој е растворлив. Кога е изложена на хлор, оваа сол дава OsO4. IВо последните фази на рафинирање, суровиот OsO4 се раствора во алкохолен NaOH формирајќи Na2[OsO2(OH)4], кој, кога е третиран со NH4Cl, дава (NH4)4[OsO2Cl2].Оваа сол се редуцира под водорот за да даде осмиум.[8]
Адукт на бакминстерфулерен[уреди | уреди извор]
OsO4 овозможи да се потврди моделот на фудбалска топка на бакминстерфулерен, јаглероден алотроп со 60 атоми. Адуктот, формиран од дериват на OsO4, беше C60(OsO4)(4-tert-бутилпиридин)2. Адуктот ја прекина симетријата на фулеренот, овозможувајќи кристализација и потврда на структурата на C60со рендгенска кристалографија.[25]
Безбедност[уреди | уреди извор]

OsO4 е многу отровен. Особено, вдишувањето во концентрации далеку под оние во кои може да се воочи мирис може да доведе до пулмонален едем и последователна смрт. Забележливите симптоми може да потраат неколку часа за да се појават по изложувањето.[се бара извор]
OsO4 неповратно ќе ја обои човечката рожница, што може да доведе до слепило. Дозволената граница на изложеност за осмиум(VIII) оксид (временски пондериран просек од 8 часа) е 2 µg/m3.[7] Осмиум(VIII) оксидот може да навлезе во пластиката и пакувањето на храната и затоа мора да се чува во стакло на ладно.[14]
На 6 април 2004 година, британските разузнавачки извори веруваа дека спречиле заговор на симпатизери на Ал Каеда да активираат бомба во која учествувал и OsO4.[26] Експертите со кои разговараше New Scientist ја потврдија токсичноста на оксидот на осмиум (VIII), иако некои ги истакнаа тешкотиите при неговото користење во оружје: оксидот на осмиум (VIII) е многу скап, може да се уништи со експлозија, а преостанатите токсични испарувања исто така може да се распрснуваат. со експлозија.[27]
Наводи[уреди | уреди извор]
- ↑ „Osmium tetroxide ICSC: 0528“. InChem.
- ↑ 2,0 2,1 2,2 2,3 „Џебен водич за опасните хемиски материи #0473“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ „Osmium tetroxide (as Os)“. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Girolami, Gregory (2012). „Osmium weighs“. Nature Chemistry. 4 (11): 954. Bibcode:2012NatCh...4..954G. doi:10.1038/nchem.1479. PMID 23089872.
- ↑ Cotton and Wilkinson, Advanced Inorganic Chemistry, p.1002
- ↑ Грешка во наводот: Погрешна ознака
<ref>; нема зададено текст за наводите по имеs1. - ↑ 7,0 7,1 „Osmium tetroxide (as Os)“. Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs). Centers for Disease Control. 2 November 2018.
- ↑ 8,0 8,1 Thompson, M. „Osmium tetroxide (OsO4)“. Bristol University. Посетено на 2012-04-07.
- ↑ Butler, I. S.; Harrod, J. F. (1989). Inorganic Chemistry: Principles and Applications. Benjamin / Cummings. стр. 343. ISBN 978-0-8053-0247-9. Посетено на 2012-04-07.
- ↑ Cotton, F. A. (2007). Advanced Inorganic Chemistry (6. изд.). New Delhi, India: J. Wiley. стр. 1002. ISBN 978-81-265-1338-3.
- ↑ 11,0 11,1 11,2 Предлошка:Housecroft2nd
- ↑ Ogino, Y.; Chen, H.; Kwong, H.-L.; Sharpless, K. B. (1991). „On the timing of hydrolysis / reoxidation in the osmium-catalyzed asymmetric dihydroxylation of olefins using potassium ferricyanide as the reoxidant“. Tetrahedron Letters. 32 (32): 3965–3968. doi:10.1016/0040-4039(91)80601-2.
- ↑ Berrisford, D. J.; Bolm, C.; Sharpless, K. B. (1995). „Ligand-Accelerated Catalysis“. Angewandte Chemie International Edition. 34 (10): 1059–1070. doi:10.1002/anie.199510591.
- ↑ 14,0 14,1 14,2 Hayat, M. A. (2000). Principles and Techniques of Electron Microscopy: Biological Applications. Cambridge University Press. стр. 45–61. ISBN 0-521-63287-0.
- ↑ Brian S. McGilligan, John Arnold, Geoffrey Wilkinson, Bilquis Hussain-Bates, Michael B. Hursthouse (1990). „Reactions of Dimesityldioxo-Osmium(VI) with Donor Ligands; Reactions of MO2(2,4,6-Me3C6H2)2, M = Os or Re, with Nitrogen Oxides. X-Ray Crystal Structures of [2,4,6-Me3C6H2N2]+[OsO2(ONO2)2(2,4,6-Me3C6H2)]–, OsO(NBut)(2,4,6-Me3C6H2)2, OsO3(NBut), and ReO3[N(2,4,6-Me3C6H2)2]“. J. Chem. Soc., Dalton Trans. (8): 2465–2475. doi:10.1039/DT9900002465.CS1-одржување: користи параметар authors (link)
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. изд.). Butterworth-Heinemann. ISBN 0080379419.
- ↑ Kiernan, J. A. „Re: "Disposal" of Osmium Tetroxide "Waste"“. Department of Anatomy & Cell Biology, The University of Western Ontario.
- ↑ Christe, K. O.; Dixon, D. A.; Mack, H. G.; Oberhammer, H.; Pagelot, A.; Sanders, J. C. P.; Schrobilgen, G. J. (1993). „Osmium tetrafluoride dioxide, cis-OsO2F4“. Journal of the American Chemical Society. 115 (24): 11279–11284. doi:10.1021/ja00077a029.
- ↑ Cotton, S. A. (1997). Chemistry of Precious Metals. London: Chapman and Hall. ISBN 0-7514-0413-6.
- ↑ Snider, B. B.; Kiselgof, J. Y.; Foxman, B. M. (1998). „Total Syntheses of (±)-Isosteviol and (±)-Beyer-15-ene-3β,19-diol by Manganese(III)-Based Oxidative Quadruple Free-Radical Cyclization“. Journal of Organic Chemistry. 63 (22): 7945–7952. doi:10.1021/jo981238x.
- ↑ Bozzola, J. J.; Russell, L. D. (1999). „Specimen Preparation for Transmission Electron Microscopy“. Electron Microscopy : Principles and Techniques for Biologists. Sudbury, MA: Jones and Bartlett. стр. 21–31. ISBN 978-0-7637-0192-5.
- ↑ Seligman, Arnold M.; Wasserkrug, Hannah L.; Hanker, Jacob S. (1966-08-01). „A new staining method (OTO) for enhancing contrast of lipid--containing membranes and droplets in osmium tetroxide--fixed tissue with osmiophilic thiocarbohydrazide(TCH)“. The Journal of Cell Biology. 30 (2): 424–432. doi:10.1083/jcb.30.2.424. ISSN 0021-9525. PMC 2106998. PMID 4165523.
- ↑ Unger, Ann-Katrin; Neujahr, Ralph; Hawes, Chris; Hummel, Eric (2020), Wacker, Irene; Hummel, Eric; Burgold, Steffen; Schröder, Rasmus (уред.), „Improving Serial Block Face SEMScanning electron microscopy (SEM)by Focal Charge Compensation“, Volume Microscopy : Multiscale Imaging with Photons, Electrons, and Ions (англиски), New York, NY: Springer US, стр. 165–178, doi:10.1007/978-1-0716-0691-9_9, ISBN 978-1-0716-0691-9, Посетено на 2023-02-06
- ↑ Tapia, Juan C.; Kasthuri, Narayanan; Hayworth, Kenneth; Schalek, Richard; Lichtman, Jeff W.; Smith, Stephen J; Buchanan, JoAnn (2012-01-12). „High contrast en bloc staining of neuronal tissue for field emission scanning electron microscopy“. Nature Protocols. 7 (2): 193–206. doi:10.1038/nprot.2011.439. ISSN 1754-2189. PMC 3701260. PMID 22240582.
- ↑ Hawkins, J. M.; Meyer, A.; Lewis, T. A.; Loren, S.; Hollander, F. J. (1991). „Crystal Structure of Osmylated C60: Confirmation of the Soccer Ball Framework“. Science. 252 (5003): 312–313. Bibcode:1991Sci...252..312H. doi:10.1126/science.252.5003.312. PMID 17769278. S2CID 36255748.
- ↑ „Chemical 'bomb plot' in UK foiled“. BBC News. 2004-04-06.
- ↑ Bhattacharya, S. (2004-04-07). „Experts divided over poison bomb claim“. New Scientist.
Надворешни врски[уреди | уреди извор]
- International Chemical Safety Card 0528
- NIOSH Pocket Guide to Chemical Hazards
- CDC - Osmium Tetroxide - NIOSH Workplace Safety and Health Topic
- BBC report on bomb plot
- BBC What is Osmium tetroxide article
- Osmium Tetroxide: Molecule of the Month
- Chemical Reactions
| ||||||||||||||||||||||||||||||||||||||||||||



![{\displaystyle {\ce {Os + 2O2 ->[\Delta T] OsO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d2c2ac06e64cd164869ed5506f13c3cfa320d70)


