Метален карбонил


Металните карбонили се координативни комплекси на преодни метали со лиганди на јаглерод моноксид. Металните карбонили се корисни во органската синтеза и како катализатори или прекурсори на катализаторите при хомогена катализа, како што се хидроформилација и Репеова хемија. Во Мондовиот процес, никел тетракарбонил се користи за производство на чист никел. Во органометалната хемија, металните карбонили служат како прекурсори за подготовка на други органометални комплекси.
Металните карбонили се токсични при контакт со кожа, вдишување или голтање, делумно поради нивната способност да го карбонилизираат хемоглобинот за да дадат карбоксихемоглобин, што го спречува врзувањето на кислородот.[1]
Номенклатура и терминологија[уреди | уреди извор]
Номенклатурата на металните карбонили зависи од полнежот на комплексот, бројот и типот на централните атоми и бројот и типот на лигандите и нивните начини на врзување. Тие се јавуваат како неутрални комплекси, како позитивно наелектризирани метални карбонилни катјони или како негативно наелектризирани метални карбонилати. Лигандот на јаглерод моноксид може да се врзе терминално за еден метален атом или да се премости со два или повеќе метални атоми. Овие комплекси може да бидат хомолептични, што содржат само CO лиганди, како што е никел тетракарбонил (Ni(CO)4), но почесто металните карбонили се хетеролептични и содржат мешавина на лиганди.
Мононуклеарните метални карбонили содржат само еден метален атом како централен атом. Освен ванадиум хексакарбонил, само металите со парен атомски број, како што се хромот, железото, никелот и нивните хомолози, градат неутрални мононуклеарни комплекси. Полинуклеарни метални карбонили се формираат од метали со непарни атомски броеви и содржат врска метал-метал. Комплексите со различни метали, но само еден тип лиганд се нарекува изолептичен.
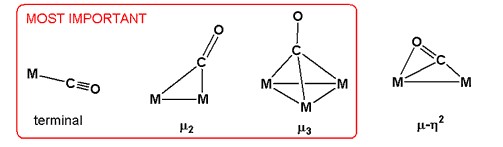
Јаглерод моноксид има различни начини на врзување во металните карбонили. Тие се разликуваат во однос на нивната хаптичност, означена со η, и нивниот начин на премостување. Во комплексите η2 - CO, и јаглеродот и кислородот се врзани за металот. Почесто само јаглеродот се врзува, во кој случај не се споменува хаптичноста.[2]
Карбонилниот лиганд се вклучува во широк опсег на начини на поврзување во метални карбонилни димери и кластери. Во најчестиот режим на премостување, означен μ 2 или едноставно μ, CO лигандот премостува пар метали. Овој начин на поврзување е забележан кај најчесто достапните метални карбонили: Co2 (CO) 8, Fe2 (CO)9, Fe3 (CO)12 и Co4 (CO)12. Во одредени кластери со повисока нуклеарност, CO се премостува помеѓу три или дури четири метали. Овие лиганди се означени μ 3 -CO и μ 4 -CO. Поретки се модовите на сврзување во кои и C и O се поврзуваат со металот, како што е μ 3 η 2 .
Структура и поврзување[уреди | уреди извор]

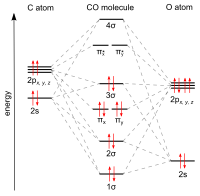
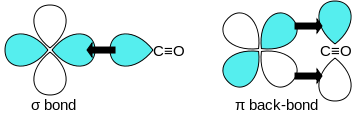
Јаглерод моноксид се поврзува со преодни метали користејќи „синергетско пи* задно поврзување“. Сврзувањето M-C има три компоненти, што доведува до делумна тројна врска. Сигма (σ) врска произлегува од преклопување на неврзувачкиот (или слабо анти-врзувачкиот) sp-хибридизиран електронски пар на јаглерод со мешавина од d-, s- и p-орбитали на металот. Пар пи (π) врски произлегува од преклопување на пополнетите d-орбитали на металот со пар п*- антиврзувачки орбитали кои излегуваат од јаглеродниот атом на CO. Последниот вид на врзување бара металот да има d-електрони и металот да е во релативно ниска оксидациска состојба (0 или +1), што го прави поволно враќањето на густината на електроните. Како што електроните од металот ја исполнуваат π-антисврзувачката орбитала на CO, тие ја ослабуваат врската јаглерод-кислород во споредба со слободниот јаглерод моноксид, додека врската метал-јаглерод се зајакнува. Поради карактерот на повеќекратна врска на поврзувањето M-CO, растојанието помеѓу металот и јаглеродниот атом е релативно кратко, честопати помало од 1,8 Å, околу 0,2 Å пократок од метал -алкилна врска. Растојанието M-CO и MC-O се чувствителни на други лиганди на металот. Илустративни за овие ефекти се следните податоци за растојанијата на Mo-C и CO во Mo(CO) 6 и Mo(CO) 3 (4-метилпиридин) 3 : 2,06 vs 1,90 и 1,11 vs 1,18 Å.[3]
Резонанцните структури на металниот карбонил, од лево кон десно, придонесите на канонските форми од десната страна се зголемуваат како што се зголемува моќта на задничко врзување на M со CO.
Инфрацрвената спектроскопија е чувствителна сонда за присуство на премостувачки карбонилни лиганди. За соединенија со двојно премостувачки CO лиганди, означени μ 2 -CO или често само μ -CO, фреквенцијата на истегнување на врската ν CO обично се поместува за 100–200 cm −1 до помала енергија во споредба со потписите на терминалот CO, кои се во регионот 1800 cm −1 . Ленти за покривање на лицето (μ 3) CO лиганди се појавуваат при уште пониски енергии. Покрај симетричните начини на премостување, CO може да се најде дека се премостува асиметрично или преку донација од метална d орбитала до π* орбиталата на CO.[4][5][6] Зголеменото π-врзување поради донирање назад од повеќе метални центри резултира со дополнително слабеење на врската C-O.
Физички одлики[уреди | уреди извор]
Повеќето мононуклеарни карбонилни комплекси се безбојни или бледо жолти испарливи течности или цврсти материи кои се запаливи и токсични. Ванадиум хексакарбонил, уникатно стабилен метален карбонил од 17 електрони, е сино-црна цврстина. Диметалните и полиметалните карбонили имаат тенденција да бидат подлабоко обоени. Трижелезен додекакарбонил (Fe3 (CO) 12 ) формира длабоко зелени кристали. Кристалните метални карбонили често се сублимливи во вакуум, иако овој процес често е придружен со деградација. Металните карбонили се растворливи во неполарни и поларни органски растворувачи како што се бензен, диетил етер, ацетон, глацијална оцетна киселина и јаглерод тетрахлорид. Некои соли на катјонски и анјонски метални карбонили се растворливи во вода или пониски алкохоли.[7]
Аналитичка карактеризација[уреди | уреди извор]

Освен рендгенската кристалографија, важни аналитички техники за карактеризација на металните карбонили се инфрацрвената спектроскопија и 13C NMR спектроскопија]]. Овие две техники обезбедуваат структурни информации на две многу различни временски скали. Инфрацрвените активни вибрациони режими, како што се вибрациите со истегнување на CO, често се брзи во споредба со интрамолекуларните процеси, додека транзициите на NMR се случуваат на пониски фреквенции и на тој начин структурите на примерокот на временска скала што, се испоставува, е споредлива со стапката на интрамолекуларниот лиганд процеси на размена. Податоците NMR обезбедуваат информации за „просечни временски структури“, додека IR е инстант „слика“.[8] Илустрација на различните временски скали, истражувањето на дикобалт октакарбонил (Co2 (CO)8) со помош на инфрацрвена спектроскопија обезбедува 13 ν CO опсези, многу повеќе од очекуваното за едно соединение. Оваа сложеност го одразува присуството на изомери со и без премостувачки CO лиганди. 13 C NMR спектарот на истата супстанција покажува само еден сигнал при хемиско поместување од 204 ppm. Оваа едноставност покажува дека изомерите брзо (на временската скала NMR) меѓусебно се претвораат.
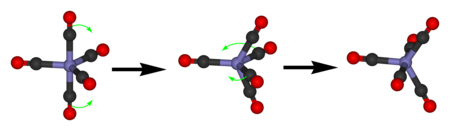
Железниот пентакарбонил покажува само единечни 13 C NMR сигнал поради брзата размена на аксијалните и екваторијалните CO лиганди со псевдоротација на Бери.
Инфрацрвени спектри[уреди | уреди извор]

Важна техника за карактеризирање на металните карбонили е инфрацрвената спектроскопија.[10] Вибрацијата C–O, типично означена ν CO, се јавува на 2143 cm −1 за гасот јаглерод моноксид. Енергиите на појасот ν CO за металните карбонили се во корелација со јачината на врската јаглерод-кислород и обратно во корелација со јачината на π-поврзувањето помеѓу металот и јаглеродот. П-основноста на металниот центар зависи од многу фактори; во изоелектронската серија (титаниум до железо) на дното на овој дел, хексакарбонилите покажуваат намалување на π-поврзувањето како што се зголемува (го прави попозитивен) полнежот на металот. π-основните лиганди ја зголемуваат густината на π-електронот кај металот, а подобрената врска го намалува νCO. Електронскиот параметар Толман го користи фрагментот Ni(CO) 3 за да ги нареди лигандите според нивните способности за π-донирање.[11][12]
Бројот на вибрациони начини на метален карбонилен комплекс може да се определи со групна теорија. Само вибрационите режими кои се трансформираат како оператор на електричен дипол ќе имаат директни производи кои не се нула и се набљудуваат. На тој начин може да се предвиди бројот на забележливи IR транзиции (но не и нивните енергии).[13][14][15] На пример, CO лигандите на октаедралните комплекси, како што е Cr(CO) <sub id="mw-A">6</sub>, се трансформираат како 1g, eg, и t 1u, но само режимот t 1u ( антисиметрично истегнување на апикалните карбонилни лиганди) е дозволено IR. Така, само еден ν CO опсег е забележан во IR спектрите на октаедарните метални хексакарбонили. Спектри за комплекси со пониска симетрија се посложени. На пример, инфрацрвениот спектар на Fe <sub id="mwAQQ">2</sub> (CO) <sub id="mwAQU">9</sub> прикажува CO опсези во 2082, 2019 и 1829 cm −1 . Бројот на IR-набљудувачки вибрациони режими за некои метални карбонили е прикажан во табелата. Достапни се исцрпни табели. Овие правила важат за метални карбонили во раствор или гасна фаза. Растворувачите со низок поларитет се идеални за висока резолуција. За мерења на цврсти примероци на метални карбонили, бројот на ленти може да се зголеми делумно поради симетријата на локацијата.[16]
| Соединение | ν CO (cm −1 ) | 13 C NMR смена (ppm) | просечно растојание M-CO (pm) | просечно растојание на CO (pm) |
|---|---|---|---|---|
| CO | 2143 | 181 | ||
| Ti(CO)2− 6 |
1748 | 245 | 204 [17] | 116 |
| V(CO)− 6 |
(парамагнетна) | 200 | 113 [18] | |
| V(CO)− 6 |
1859 | 193 (PPN + сол) [18] | ||
| Cr(CO) 6 | 2000 | 212 | 191 [19] | 114 |
| Mn(CO)+ 6 |
2100 | |||
| Fe(CO)2+ 6</br> Fe(CO)2+ 6 |
2204 | 191 | 112 (BF 4 − сол) [20] | |
| Fe (CO) 5 | 2022, 2000 | 209 | 180 [21] | 112 |
| Ru(CO) 5 | 2038, 2002 [22] | |||
| Ni (CO) 4 | 181 | 113 |
| Карбонил | ν CO, µ 1 (cm −1 ) | ν CO, µ2 ( cm −1 ) | ν CO, µ 3 (cm −1 ) |
|---|---|---|---|
| Rh 2 (CO) 8 | 2060, 2084 | 1846, 1862 | |
| Rh 4 (CO) 12 | 2044, 2070, 2074 | 1886 | |
| Rh 6 (CO) 16 | 2045, 2075 | 1819 |
Спектроскопија на јадрена магнетна резонанца[уреди | уреди извор]
Металните карбонили често се одликуваат со <sup id="mwAZ0">13</sup> C<span typeof="mw:Entity" id="mwAZ4"> </span>NMR спектроскопија. За да се подобри чувствителноста на оваа техника, комплексите често се збогатуваат со 13 CO. Типичниот опсег на хемиски поместувања за терминално врзани лиганди е од 150 до 220 ppm. Премостувачките лиганди резонираат помеѓу 230 и 280 ppm. Сигналите од 13C се префрлаат кон повисоки полиња со зголемен атомски број на централниот метал.
NMR спектроскопијата може да се користи за експериментално определување на флуксионалноста.[23]
Енергијата на активирање на процесите на размена на лиганди може да се определи со температурната зависност на линијата проширување.[24]
Масовна спектрометрија[уреди | уреди извор]
Масовната спектрометрија дава информации за структурата и составот на комплексите. Спектрите за метални поликарбонили честопати лесно се толкуваат, бидејќи доминантен процес на фрагментација е губењето на карбонилните лиганди ( <i id="mwAbM">m</i> / <i id="mwAbQ">z</i> = 28).
- M(CO)+
n → M(CO)+
n−1 + CO
Електронската јонизација е најчеста техника за карактеризирање на неутралните метални карбонили. Неутралните метални карбонили може да се претворат во наелектризирани видови со дериватизација, што овозможува користење на јонизација со електропрскање (ESI), инструменти за кои често се широко достапни. На пример, третманот на метален карбонил со алкоксид генерира анјонски металаформат кој е подложен на анализа со ESI-MS:
- L n M(CO) + RO − → [L n M−C(=O)OR] −
Некои метални карбонили реагираат со азид и даваат изоцијанато комплекси со ослободување на азот.[25] Со прилагодување на напонот или температурата на конусот, може да се контролира степенот на фрагментација. Може да се одреди моларната маса на матичниот комплекс, како и информации за структурните преуредувања кои вклучуваат губење на карбонилни лиганди во услови на ESI-MS.[26]
Масовната спектрометрија во комбинација со инфрацрвена фотодисоцијациска спектроскопија може да обезбеди вибрациони информации за јонските карбонилни комплекси во гасната фаза.[27]
Појава во природата[уреди | уреди извор]

Во истражувањето на инфрацрвениот спектар на Галактичкиот центар на Млечниот Пат, откриени се вибрации на моноксид на железните карбонили во меѓуѕвездените облаци од прашина.[29] Железни карбонилни кластери биле забележани и кај Jiange H5 хондритите идентификувани со инфрацрвена спектроскопија. Пронајдени се четири инфрацрвени фреквенции на истегнување за терминалните и премостувачките лиганди на јаглерод моноксид.[30]
Во атмосферата богата со кислород на Земјата, металните карбонили се предмет на оксидација на металните оксиди. Се дискутира дали во редуцирачките хидротермални средини на пребиотичката праисторија биле формирани такви комплекси и би можеле да бидат достапни како катализатори за синтеза на критични биохемиски соединенија како што е пирувична киселина.[31] Траги од карбонилите од железо, никел и волфрам биле пронајдени во гасните еманации од тињата од отпадните води на општинските пречистителни станици.[32]
Ензимите на хидрогеназа содржат CO врзан за железо. Се смета дека CO ги стабилизира ниските оксидациски состојби, што го олеснува врзувањето на водородот . Ензимите јаглерод моноксид дехидрогеназа и ацетил-CoA синтаза, исто така, се вклучени во биопроцесирањето на CO.[33] Комплексите што содржат јаглерод моноксид се повикуваат за токсичноста на CO и сигнализацијата.[34]
Синтеза[уреди | уреди извор]
Синтезата на метални карбонили е широко проучен предмет на органометални истражувања. Од работата на Монд, а потоа и на Хибер, развиени се многу процедури за подготовка на мононуклеарни метални карбонили, како и хомо- и хетерометални карбонилни кластери.[35]
Директна реакција на метал со јаглерод моноксид[уреди | уреди извор]
Никел тетракарбонил и железо пентакарбонил може да се подготват според следните равенки со реакција на ситно поделен метал со јаглерод моноксид:[36]
- Ни + 4 CO → Ni(CO) 4 (1 бар, 55 °C)
- Fe + 5 CO → Fe(CO) 5 (100 бари, 175 °C)
Никел тетракарбонил се формира со јаглерод моноксид веќе на 80 °C и атмосферски притисок, ситно поделеното железо реагира на температури помеѓу 150 и 200 °C и притисок на јаглерод моноксид од 50–200 бар.[37] Другите метални карбонили се подготвуваат со помалку директни методи.[38]
Намалување на метални соли и оксиди[уреди | уреди извор]
Некои метални карбонили се подготвуваат со редукција на метални халиди во присуство на висок притисок на јаглерод моноксид. Се користат различни средства за намалување, вклучувајќи бакар, алуминиум, водород, како и метални алкили како што е триетилалуминиум. Илустративно е формирањето на хром хексакарбонил од безводен хром(III) хлорид во бензен со алуминиум како редукционо средство и алуминиум хлорид како катализатор:
- CrCl 3 + Al + 6 CO → Cr(CO) 6 + AlCl 3
Употребата на метални алкили, како што се триетилауминиум и диетилцинк, како редукционо средство доведува до оксидативно спојување на алкилниот радикал за да се формира димер алкан:
- WCl 6 + 6 CO + 2 Al(C 2 H 5 ) 3 → W(CO) 6 + 2 AlCl 3 + 3 C 4 H 10
Солите на волфрам, молибден, манган и родиум може да се редуцираат со литиум алуминиум хидрид. Ванадиум хексакарбонил се подготвува со натриум како редукционо средство во хелатни растворувачи како што е диглим.
- VCl 3 + 4 Na + 6 CO + 2 диглима → Na(диглима) 2 [V(CO) 6 ] + 3 NaCl
- [V(CO) 6 ] − + H + → H[V(CO) 6 ] →12 H 2 + V (CO) 6
Во водната фаза, солите на никел или кобалт може да се редуцираат, на пример со натриум дитионит. Во присуство на јаглерод моноксид, кобалтните соли квантитативно се претвораат во анјон на тетракарбонилкобалт(-1):
- Co 2+ +32 S2O2−
4+ 6 OH − + 4 CO → Co(CO)−
4 + 3 SO2−
3+ 3 H 2 O
Некои метални карбонили се подготвуваат со користење на CO директно како средство за намалување . На овој начин, Хибер и Фукс прво подготвиле дирениум декакарбонил од оксидот:[39]
- Re 2 O 7 + 17 CO → Re 2 (CO) 10 + 7 CO 2
Ако се користат метални оксиди , јаглеродниот диоксид се формира како производ на реакција. Во редукцијата на металните хлориди со јаглерод моноксид се формира фосген, како и при подготовката на осмиум карбонил хлорид од хлоридните соли. Јаглерод моноксидот е исто така погоден за редукција на сулфиди, каде што карбонил сулфидот е нуспроизвод.
Фотолиза и термолиза[уреди | уреди извор]
Со фотолиза или термолиза на мононуклеарни карбонили се генерираат ди- и полиметални карбонили, како што е дијонскиот нонакарбонил (Fe 2 (CO) 9).[40][41] При дополнително загревање, производите на крајот се распаѓаат на метал и јаглерод моноксид.
- 2 Fe(CO) 5 → Fe 2 (CO) 9 + CO
Термичкото распаѓање на триосмиум додекакарбонил (Os 3 (CO) 12 ) обезбедува кластери со повисок јадрен осмиум карбонил како што се Os 4 (CO) 13, Os 6 (CO) 18 до Os 8 (CO) 23.[42]
Мешаните лиганди карбонили на рутениум, осмиум, родиум и иридиум често се генерираат со апстракција на CO од растворувачи како што се диметилформамид (DMF) и 2-метоксиетанол. Типична е синтезата на IrCl(CO) (PPh <sub id="mwAq8">3</sub> ) <sub id="mwArA">2</sub> од реакцијата на иридиум (III) хлорид и трифенилфосфин во раствор од DMF што врие.[43]
Метатеза на сол[уреди | уреди извор]
Реакцијата на метатеза на сол на соли како KCo(CO) 4 со [Ru(CO) 3 Cl 2 ] 2 води селективно до карбонили со мешан метал како што е RuCo 2 (CO) 11.[44]
- 4 KCo(CO) 4 + [Ru(CO) 3 Cl 2 ] 2 → 2 RuCo 2 (CO) 11 + 4 KCl + 11 CO
Метални карбонилни катјони и карбонилати[уреди | уреди извор]
Синтезата на јонски карбонилни комплекси е можна со оксидација или редукција на неутралните комплекси. Анјонски метални карбонилати може да се добијат на пример со редукција на двонуклеарни комплекси со натриум. Познат пример е натриумовата сол на железо тетракарбонилат (Na 2 Fe(CO) 4), која се користи во органската синтеза.[45]
Катјонските хексакарбонилни соли на манган, технициум и рениум може да се подготват од карбонил халидите под притисок на јаглерод моноксид со реакција со Луисова киселина.
- Mn(CO)5Cl + AlCl<sub id="mwAt0">3</sub> + CO → [Mn(CO)+
6][AlCl−
4]
Употребата на силни киселини успеала да подготви златни карбонилни катјони како што е [Au(CO) 2 ] +, кој се користи како катализатор за карбонилирање на алкените.[46] Катјонскиот платина карбонилен комплекс [Pt(CO) 4 ] 2+ може да се подготви со работа во таканаречените суперкиселини како што е антимон пентафлуорид.[47] Иако CO генерално се смета како лиганд за нисковалентни метални јони, тетравалентниот железен комплекс [Cp* 2 Fe] 2+ (16-валентен електронски комплекс) квантитативно го врзува CO за да го даде дијамагнетниот Fe(IV)-карбонил [Cp* 2 FeCO] 2+ (18-валентен електронски комплекс).[48]
Реакции[уреди | уреди извор]
Металните карбонили се важни прекурсори за синтеза на други органометални комплекси. Вообичаени реакции се замена на јаглерод моноксид со други лиганди, реакции на оксидација или редукција на металниот центар и реакции на лигандот на јаглерод моноксид.
Замена на CO[уреди | уреди извор]
Замената на CO лиганди може да биде термички или фотохемиски индуцирана од донорски лиганди. Опсегот на лиганди е голем и вклучува фосфини, цијанид ( CN- ), донори на азот, па дури и етери, особено хелатни. Алкените, особено диените, се ефективни лиганди кои даваат синтетички корисни деривати. Замена на 18-електронски комплекси генерално следи дисоцијативен механизам, кој вклучува 16-електронски посредници.[49]
- M(CO) n → M(CO) n −1 + CO
- M(CO) n −1 + L → M(CO) n −1 L
Енергијата на дисоцијација е 105 kJ/mol (25 kcal/mol) за никел тетракарбонил и 155 kJ/mol (37 kcal/mol) за хром хексакарбонил.
Замената во 17-електронските комплекси, кои се ретки, се одвива преку асоцијативни механизми со 19-електронски посредници.
- M(CO) n + L → M(CO) n L
- M(CO) n L → M(CO) n −1 L + CO
Стапката на супституција во 18-електронските комплекси понекогаш се катализира од каталитички количини на оксиданти, преку пренос на електрони.[50]
Намалување[уреди | уреди извор]
Металните карбонили реагираат со редуцирачки агенси како што се метален натриум или натриум амалгам за да дадат карбонилметалат (или карбонилат) анјони:
- Mn 2 (CO) 10 + 2 Na → 2 Na[Mn(CO) 5 ]
За железо пентакарбонил, се добива тетракарбонилферат со губење на CO:
- Fe(CO) 5 + 2 Na → Na 2 [Fe(CO) 4 ] + CO
Живата може да се вметне во врските метал-метал на некои полинуклеарни метални карбонили:
- Co 2 (CO) 8 + Hg → (CO) 4 Co−Hg−Co(CO) 4
Нуклеофилен напад на CO[уреди | уреди извор]
CO лигандот често е подложен на напад од нуклеофили. На пример, триметиламин оксидот и калиум бис (триметилсилил)амидот ги претвораат CO лигандите во CO2 и CN-, соодветно. Во „ Хиберовата базна реакција“, хидроксидниот јон го напаѓа CO лигандот за да даде металакарбоксилна киселина, проследено со ослободување на јаглерод диоксид и формирање на метални хидриди или карбонилметалати. Добро проучен пример за овој нуклеофилен додаток е конверзијата на железо пентакарбонил во хидроирон тетракарбонил анјон:
- Fe(CO) 5 + NaOH → Na[Fe(CO) 4 CO 2 H]
- Na[Fe(CO) 4 COOH] + NaOH → Na[HFe(CO) 4 ] + NaHCO 3
Хидридните реагенси, исто така, ги напаѓаат CO лигандите, особено во катјонските метални комплекси, за да го дадат дериватот на формил:
- [Re(CO) 6 ] + + H − → Re(CO) 5 CHO
Органолитиумските реагенси се додаваат со метални карбонили во ацилметалните карбонилни анјони. О - алкилацијата на овие анјони, како на пример со Мервеиновите соли, дава Фишер карбени.
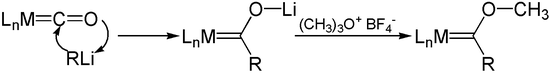
Со електрофили[уреди | уреди извор]
И покрај тоа што се во ниски формални состојби на оксидација, металните карбонили се релативно нереактивни кон многу електрофили. На пример, тие се спротивставуваат на напад од алкилирачки агенси, благи киселини и благи оксидирачки агенси. Повеќето метални карбонили се подложени на халогенација. Железо пентакарбонил, на пример, формира црни карбонил халиди:
- Fe(CO) 5 + X 2 → Fe(CO) 4 X 2 + CO
Врските метал-метал се расцепуваат со халогени. Во зависност од употребената шема за броење електрони, ова може да се смета како оксидација на металните атоми:
- Mn 2 (CO) 10 + Cl 2 → 2 Mn (CO) 5 Cl
Соединенија[уреди | уреди извор]
Повеќето метални карбонилни комплекси содржат мешавина на лиганди. Примерите го вклучуваат историски важниот IrCl(CO)(P(C <sub id="mwA4A">6</sub> H <sub id="mwA4E">5</sub>) <sub id="mwA4I">3</sub>) <sub id="mwA4M">2</sub> и средството против тропање (CH <sub id="mwA4Y">3</sub> C <sub id="mwA4c">5</sub> H <sub id="mwA4g">4</sub> )Mn (CO) <sub id="mwA4k">3</sub>. Главните соединенија за многу од овие мешани лиганди комплекси се бинарните карбонили, оние видови со формулата [M x (CO) n ] z, од кои многу се комерцијално достапни. Формулите на многу метални карбонили може да се заклучат од правилото за 18 електрони.
Бинарни метални карбонили со неутрален полнеж[уреди | уреди извор]
- Елементите од групата 2, калциум, стронциум и бариум можат да формираат октакарбонилни комплекси M(CO) <sub id="mwA5k">8</sub> (M = Ca, Sr, Ba). Соединенијата биле карактеризирани во криогени матрици со вибрациона спектроскопија и во гасна фаза со масена спектрометрија.[51]
- Елементите од групата 4 со 4 валентни електрони се очекува да формираат хептакарбонили; додека овие се исклучително ретки, познати се супституирани деривати на Ti(CO) 7 .
- Елементите од групата 5 со 5 валентни електрони, повторно се предмет на стерични ефекти кои го спречуваат формирањето на M–M врзани видови како што е V 2 (CO) 12, што е непознато. Сепак, 17-VE V(CO) <sub id="mwA6Q">6</sub> е добро познат.
- Елементите од групата 6 со 6 валентни електрони формираат хексакарбонили Cr(CO) <sub id="mwA6g">6</sub>, Mo(CO) <sub id="mwA6o">6</sub>, W(CO) <sub id="mwA6w">6</sub> и Sg(CO) 6. Елементите од групата 6 (како и групата 7) се исто така добро познати по тоа што го покажуваат ефектот <i id="mwA68">цис</i> (лабилизација на CO во цис позиција) во органометалната синтеза.
- Елементите од групата 7 со 7 валентни електрони формираат пентакарбонилни димери Mn <sub id="mwA7M">2</sub> (CO) <sub id="mwA7Q">10</sub>, Tc 2 (CO) 10 и Re <sub id="mwA7g">2</sub> (CO) <sub id="mwA7k">10</sub> .
- Елементите од 8-та група со 8 валентни електрони формираат пентакарбонили Fe(CO) <sub id="mwA70">5</sub>, Ru(CO) <sub id="mwA78">5</sub> и Os(CO) <sub id="mwA8E">5</sub> . Потешките два члена се нестабилни, со тенденција да се декарбонилираат за да дадат Ru <sub id="mwA8M">3</sub> (CO) <sub id="mwA8Q">12</sub> и Os <sub id="mwA8Y">3</sub> (CO) <sub id="mwA8c">12</sub>. Двата други главни железни карбонили се Fe <sub id="mwA8k">3</sub> (CO) <sub id="mwA8o">12</sub> и Fe <sub id="mwA8w">2</sub> (CO) <sub id="mwA80">9</sub>.
- Група 9 елементи со 9 валентни електрони и се очекува да формираат тетракарбонилни димери M 2 (CO)8 . Всушност, кобалтниот дериват на овој октакарбонил е единствениот стабилен член, но сите три тетрамери се добро познати: Co <sub id="mwA9M">4</sub> (CO) <sub id="mwA9Q">12</sub>, Rh <sub id="mwA9Y">4</sub> (CO) <sub id="mwA9c">12</sub>, Rh <sub id="mwA9k">6</sub> (CO) <sub id="mwA9o">16</sub> и Ir <sub id="mwA9w">4</sub> (CO) <sub id="mwA90">12</sub> . Co <sub id="mwA98">2</sub> (CO) <sub id="mwA-A">8</sub> за разлика од повеќето други 18 VE карбонили на преодниот метал е чувствителен на кислород.
- Елементите од групата 10 со 10 валентни електрони формираат тетракарбонили како Ni(CO) <sub id="mwA-Q">4</sub>. Интересно, Pd(CO) 4 и Pt(CO) 4 не се стабилни.
Анјонски бинарни метални карбонили[уреди | уреди извор]
- Елементите од групата 3 скандиум и итриум формираат моноаниони, [M(CO) 8 ] − (M = Sc, Y) кои се карбонили од 20 електрони, како и лантанид лантан.[52]
- Елементите од групата 4 како дијаниони личат на деривати од неутралната група 6: [Ti(CO) 6 ] 2−.[53]
- Елементите од групата 5 како моноанјони повторно личат на деривати од неутралната група 6: [V(CO) 6 ] −.
- Елементите од групата 7 како моноанјони личат на деривати на неутралната група 8: [M(CO) 5 ] - (M = Mn, Tc, Re).
- Елементите од групата 8 како дијајони наликуваат на деривати од неутралната група 10: [M(CO) <sub id="mwBAM">4</sub> ] <sup id="mwBAQ">2−</sup> (M = Fe, Ru, Os). Познати се и кондензирани деривати.
- Елементите од групата 9 како моноанјони личат на металниот карбонил од неутралната група 10. [Co(CO) 4 ] - е најдобро проучен член.
Добро познати се и големите анјонски кластери на никел, паладиум и платина. Многу метални карбонилни анјони може да се протонираат за да се добијат метални карбонилни хидриди
Катјонски бинарни метални карбонили[уреди | уреди извор]
- Елементите од групата 2 формираат [M(CO) <sub id="mwBBM">8</sub> ] <sup id="mwBBQ">+</sup> (M = Ca, Sr, Ba), кои се одликуваат во гасна фаза со масена спектрометрија и вибрациона спектроскопија.
- Елементите од групата 3 формираат [Sc(CO) 7 ] + и [Y(CO) 8 ] + во гасната фаза.[54]
- Елементите од групата 7 како монокации наликуваат на дериват на неутралната група 6 [M(CO) 6 ] + (M = Mn, Tc, Re).
- Елементите од групата 8 како дикации, исто така, личат на деривати на неутралната група 6 [M(CO) 6 ] 2+ (M = Fe, Ru, Os).[55]
Некласични карбонилни комплекси[уреди | уреди извор]
Некласично ги опишува оние карбонилни комплекси каде што ν CO е повисок од оној за слободниот јаглерод моноксид. Во некласични CO комплекси, растојанието на CO е пократко од слободниот CO (113,7 pm). Структурата на [Fe(CO) 6 ] 2+, со d CO = 112,9 pm, го илустрира овој ефект. Овие комплекси се обично катјонски, понекогаш и дикациски.[56]
Апликации[уреди | уреди извор]

Металуршки употреби[уреди | уреди извор]
Металните карбонили се користат во неколку индустриски процеси. Можеби најраната примена била екстракција и прочистување на никел преку никел тетракарбонил со Мондовиот процес.
Со сличен процес карбонил железото, високо чист метален прав, се подготвува со термичко распаѓање на железо пентакарбонил. Карбонилното железо се користи меѓу другото за подготовка на индуктори, пигменти, како додатоци во исхраната,[57] во производството на материјали што апсорбираат радари во технологијата на стелт,[58] и во термичкото прскање.
Катализа[уреди | уреди извор]
Металните карбонили се користат во голем број индустриски важни реакции на карбонилација. Во Оксовиот процес, алкен, водороден гас и јаглерод моноксид реагираат заедно со катализатор (како што е дикобалт октакарбонил) и даваат алдехиди. Илустративно е производството на бутиралдехид од пропилен:
- CH 3 CH = CH 2 + H 2 + CO → CH 3 CH 2 CH 2 CHO
Бутиралдехидот се претвора во индустриски размери во 2-етилхексанол, претходник на ПВЦ пластификаторите, со кондензација на алдол, проследено со хидрогенизација на добиениот хидроксиалдехид. „Оксо алдехидите“ кои произлегуваат од хидроформилацијата се користат за голема синтеза на масни алкохоли, кои се прекурсори на детергентите. Хидроформилацијата е реакција со висока атомска економичност, особено ако реакцијата се одвива со висока региоселективност.
Друга важна реакција катализирана од метални карбонили е хидрокарбоксилацијата. Примерот подолу е за синтеза на естри на акрилна киселина и акрилна киселина:
Исто така, циклизацијата на ацетилен до циклооктатетраен користи метални карбонилни катализатори:[59]
Во процесите Монсанто и Катива, оцетната киселина се произведува од метанол, јаглерод моноксид и вода користејќи водород јодид, како и родиум и иридиум карбонилни катализатори, соодветно. Поврзани реакции на карбонилација даваат оцетен анхидрид.[60]
Молекули кои ослободуваат CO (CO-RMs)[уреди | уреди извор]
Молекулите кои ослободуваат јаглерод моноксид се метални карбонилни комплекси кои се развиваат како потенцијални лекови за ослободување на CO. При ниски концентрации, CO функционира како вазодилататорен и антиинфламаторно средство. CO-RMs се замислени како фармаколошки стратешки пристап за носење и испорака на контролирани количини на CO до ткивата и органите.[61]
Поврзани соединенија[уреди | уреди извор]
Познато е дека многу лиганди формираат хомолептични и мешани комплекси на лиганди кои се аналогни на металните карбонили.
Нитрозилни комплекси[уреди | уреди извор]
Металните нитросили, соединенија кои не содржат лиганди, се многубројни. За разлика од металните карбонили, сепак, хомолептичните метални нитросили се ретки. NO е посилен π-прифаќач од CO. Добро познатите нитросил карбонили вклучуваат CoNO(CO) <sub id="mwBJI">3</sub> и Fe(NO) 2 (CO) 2, кои се аналози на Ni(CO) 4.[62]
Тиокарбонилни комплекси[уреди | уреди извор]
Комплексите кои содржат CS се познати, но невообичаени.[63][64] Реткоста на таквите комплекси делумно се должи на фактот дека очигледниот изворен материјал, јаглерод моносулфид, е нестабилен. Така, синтезата на тиокарбонилните комплекси бара индиректни патишта, како што е реакцијата на динатриум тетракарбонилферат со тиофосген:
- Na 2 Fe (CO) 4 + CSCl 2 → Fe (CO) 4 CS + 2 NaCl
Се одликуваат комплекси на CSe и CTe.[65]
Комплекси на изоцијаниди[уреди | уреди извор]
Изоцијанидите исто така формираат широки семејства на комплекси кои се поврзани со металните карбонили. Типични изоцијанидни лиганди се метил изоцијанид и <i id="mwBLM">т</i> -бутил изоцијанид (Me 3 CNC). Посебен случај е CF <sub id="mwBLY">3</sub> NC, нестабилна молекула која формира стабилни комплекси чие однесување е тесно паралелно со тоа на металните карбонили.[66]
Токсикологија[уреди | уреди извор]
Токсичноста на металните карбонили се должи на токсичноста на јаглерод моноксидот, металот, и поради испарливоста и нестабилноста на комплексите, секоја инхерентна токсичност на металот генерално е многу потешка поради леснотијата на изложување. Изложеноста се јавува со вдишување, или за течни метални карбонили со голтање или поради добрата растворливост во масти со ресорпција на кожата. Најмногу клиничко искуство е стекнато од токсиколошко труење со никел тетракарбонил и железо пентакарбонил поради нивната употреба во индустријата. Никел тетракарбонил се смета за еден од најсилните отрови за инхалација.[67]
Вдишувањето на никел тетракарбонил предизвикува акутни неспецифични симптоми слични на труење со јаглерод моноксид, како што се гадење, кашлица, главоболка, треска и вртоглавица. По некое време, се јавуваат тешки белодробни симптоми како кашлица, тахикардија и цијаноза или проблеми во гастроинтестиналниот тракт. Покрај патолошките промени на белите дробови, како што е метализацијата на алвеолите, се забележуваат оштетувања во мозокот, црниот дроб, бубрезите, надбубрежните жлезди и слезината. Труењето со метален карбонил често бара долго закрепнување.[68]
Хроничната изложеност со вдишување на ниски концентрации на никел тетракарбонил може да предизвика невролошки симптоми како што се несоница, главоболки, вртоглавица и губење на меморијата. Никел тетракарбонил се смета за канцероген, но може да потрае од 20 до 30 години од почетокот на изложеноста на клиничката манифестација на ракот.[69]
Историја[уреди | уреди извор]

Првичните експерименти за реакцијата на јаглерод моноксид со метали беа спроведени од Јустус фон Либих во 1834 година. Со поминување на јаглерод моноксид преку стопен калиум, тој подготвил супстанца со емпириска формула KCO, која ја нарекол Kohlenoxidkalium .[70] Како што било докажано подоцна, соединението не било карбонил, туку калиумова сол на бензенехексол (K 6 C 6 O 6 ) и калиумова сол на ацетилендиол (K 2 C 2 O 2 ).

Синтезата на првиот вистински хетеролептичен метален карбонилен комплекс била изведена од Пол Шиценбергер во 1868 година со поминување на хлор и јаглерод моноксид над платинесто црно, каде што се формирал дикарбонилдихлороплатинум (Pt(CO) 2 Cl 2 ).[71]
Лудвиг Монд, еден од основачите на Imperial Chemical Industries, истражувал во 1890-тите со Карл Лангер и Фридрих Квинке различни процеси за обновување на хлорот кој бил изгубен во Солвејовиот процес од металите на никелот, оксидите и солите. Како дел од нивните експерименти групата третирала никел со јаглерод моноксид. Тие откриле дека добиениот гас го обоил гасниот пламен на горилникот во зеленикаво-жолтеникава боја; кога ќе се загрее во стаклена цевка формирал огледало од никел. Гасот може да се кондензира во безбојна течност проѕирна за вода со точка на вриење од 43 °C. Така, Монд и неговиот колега го откриле првиот чист, хомолептичен метал карбонил, никел тетракарбонил (Ni(CO)4).[72] Невообичаената висока испарливост на металното соединение никел тетракарбонил го навело Келвин до изјавата дека Монд „им дал крилја на тешките метали“.[73]

Следната година, Монд и Марселин Бертелот независно откриле железен пентакарбонил, кој се произведува со слична постапка како никел тетракарбонил. Монд го препознал економскиот потенцијал на оваа класа на соединенија, кои комерцијално ги користел во процесот Монд и финансирал повеќе истражувања за сродни соединенија. Хајнрих Хирц и неговиот колега М. Далтон Ковап синтетизирале метални карбонили од кобалт, молибден, рутениум и дионекарбонил од железо.[74][75] Во 1906 година, Џејмс Девар и Х.О. Џонс успеале да ја утврдат структурата на нонакарбонилот ди железен, кој се добива од железен пентакарбонил со дејство на сончева светлина.[76] По Монд, кој починал во 1909 година, хемијата на металните карбонили паднала неколку години во заборав. BASF го започнал во 1924 година индустриското производство на железо пентакарбонил со процес кој бил развиен од Алвин Миташ. Железниот пентакарбонил се користел за производство на железо со висока чистота, таканаречено карбонилно железо и пигмент од железо оксид. Дури во 1927 година, А. Џоб и А. Касал успеале во подготовката на хром хексакарбонил и волфрам хексакарбонил, првата синтеза на други хомолептични метални карбонили.
Волтер Хибер одиграл одлучувачка улога во развојот на хемијата на метал карбонил во годините по 1928 година. Тој систематски ја истражувал и открил, меѓу другото, реакцијата на Хиберовата база, првиот познат пат до метални карбонил хидриди и синтетички патишта што водат до метални карбонили како што е дирениум декакарбонил.[77] Хибер, кој од 1934 година бил директор на Институтот за неорганска хемија на Техничкиот универзитет во Минхен, во четири децении објавил 249 трудови за хемијата за металот карбонил.

Исто така во 1930-тите Волтер Репе, индустриски хемичар и подоцна член на одборот на BASF, открил голем број хомогени каталитички процеси, како што е хидрокарбоксилацијата, во која олефините или алкините реагираат со јаглерод моноксид и вода за да формираат производи како што се незаситените киселини и нивните деривати. Во овие реакции, на пример, никел-тетракарбонилните или кобалтните карбонили дејствуваат како катализатори.[78] Репе, исто така, ја открил циклотримеризацијата и тетрамеризацијата на ацетиленот и неговите деривати во бензен и деривати на бензен со метални карбонили како катализатори. BASF изградил во 1960-тите производствен капацитет за акрилна киселина со процесот Репе, кој бил заменет дури во 1996 година со посовремени методи базирани на каталитичка оксидација на пропилен.
За рационално дизајнирање на нови комплекси, се нашол корисен концептот на изолобалната аналогија. За развојот на концептот на Роалд Хофман му била доделена Нобеловата награда за хемија. Ова ги опишува металните карбонилни фрагменти од M(CO) n како делови од октаедрални градежни блокови во аналогија на тетраедарските фрагменти CH 3 –, CH 2 – или CH– во органската хемија. На пример, диманган декакарбонил е формиран во однос на изолобалната аналогија на два фрагменти од d 7 Mn(CO) 5, кои се изолобални на метил радикалот CH•
3 . Во аналогија на тоа како метил радикалите се комбинираат за да формираат етан, тие можат да се комбинираат во диманган декакарбонил. Присуството на изолобални аналогни фрагменти не значи дека може да се синтетизираат саканите структури. Во своето предавање за Нобеловата награда Хофман нагласил дека изолобалната аналогија е корисна, но е едноставен модел и во некои случаи не води до успех.[79]
Економските придобивки од карбонилациите катализирани со метал, како што се Репеовата хемија и хидроформилација, довеле до раст на областа. Металните карбонилни соединенија биле откриени во активните места на три природни ензими.[80]
Наводи[уреди | уреди извор]
- ↑ Elschenbroich, C. (2006). Organometallics. Weinheim: Wiley-VCH. ISBN 978-3-527-29390-2.
- ↑ Cotton, F. Albert (1968). „Proposed nomenclature for olefin-metal and other organometallic complexes“. Journal of the American Chemical Society. 90 (22): 6230–6232. doi:10.1021/ja01024a059.
- ↑ Schut, D. A.; Tyler, D. R.; Weakley, T. J. R. (1996). „The Crystal Structure of Tris(4-methylpyridine) Tricarbonylmolybdenum(0)“. J Chem Crystallogr. 26 (3): 235–237. doi:10.1007/BF01673678.
- ↑ Spessard, G. O.; Miessler, G. L. (2010). Organometallic Chemistry (2. изд.). New York: Oxford University Press. стр. 79–82. ISBN 978-0-19-533099-1.
- ↑ Sargent, A. L.; Hall, M. B. (1989). „Linear Semibridging Carbonyls. 2. Heterobimetallic Complexes Containing a Coordinatively Unsaturated Late Transition Metal Center“. Journal of the American Chemical Society. 111 (5): 1563–1569. doi:10.1021/ja00187a005.
- ↑ Li, P.; Curtis, M. D. (1989). „A New Coordination Mode for Carbon Monoxide. Synthesis and Structure of Cp4Mo2Ni2S2(η1, μ4-CO)“. Journal of the American Chemical Society. 111 (21): 8279–8280. doi:10.1021/ja00203a040.
- ↑ McFarlane, W.; Wilkinson, G. (1966). „Triiron Dodecacarbonyl“. Inorganic Syntheses. Inorganic Syntheses. 8. стр. 181–183. doi:10.1002/9780470132395.ch47. ISBN 9780470132395.
- ↑ Londergan, C. H.; Kubiak, C. P. (2003). „Electron Transfer and Dynamic Infrared-Band Coalescence: It Looks like Dynamic NMR spectroscopy, but a Billion Times Faster“. Chemistry: A European Journal. 9 (24): 5962–5969. doi:10.1002/chem.200305028. PMID 14679508.
- ↑ Miessler, G. L.; Tarr, D. A. (2011). Inorganic Chemistry. Upper Saddle River, NJ: Pearson Prentice Hall. стр. 109–119, 534–538.
- ↑ Braterman, P. S. (1975). Metal Carbonyl Spectra. Academic Press.
- ↑ Crabtree, R. H. (2005). „4. Carbonyls, Phosphine Complexes, and Ligand Substitution Reactions“. The Organometallic Chemistry of the Transition Metals (4. изд.). стр. 87–124. doi:10.1002/0471718769.ch4. ISBN 9780471718765.
- ↑ Tolman, C. A. (1977). „Steric effects of Phosphorus Ligands in Organometallic Chemistry and Homogeneous Catalysis“. Chemical Reviews. 77 (3): 313–348. doi:10.1021/cr60307a002.
- ↑ Cotton, F. A. (1990). Chemical Applications of Group Theory (3rd. изд.). Wiley Interscience. ISBN 978-0-471-51094-9.
- ↑ Carter, R. L. (1997). Molecular Symmetry and Group Theory. Wiley. ISBN 978-0-471-14955-2.
- ↑ Harris, D. C.; Bertolucci, M. D. (1980). Symmetry and Spectroscopy: Introduction to Vibrational and Electronic Spectroscopy. Oxford University Press. ISBN 978-0-19-855152-2.
- ↑ H. J. Buttery, G. Keeling, S. F. A. Kettle, I. Paul and P. J. Stamper (1969). „Correlation between crystal structure and carbonyl-bond stretching vibrations of methyl benzene transition metal tricarbonyls“. Discuss. Faraday Soc. 47: 48. doi:10.1039/DF9694700048.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Ellis, John E.; Chi, Kai Ming (1990). „Highly reduced organometallics. 28. Synthesis, isolation, and characterization of [K(cryptand 2.2.2)]2[Hf(CO)6], the first substance to contain hafnium in a negative oxidation state. Structural characterization of [K(cryptand 2.2.2)]2[M(CO)6].cntdot.pyridine (M = Ti, Zr, and Hf)“. Journal of the American Chemical Society. American Chemical Society (ACS). 112 (16): 6022–6025. doi:10.1021/ja00172a017. ISSN 0002-7863.
- ↑ 18,0 18,1 Bellard, S.; Rubinson, K. A.; Sheldrick, G. M. (1979). „Crystal and Molecular Structure of Vanadium Hexacarbonyl“. Acta Crystallographica. B35 (2): 271–274. doi:10.1107/S0567740879003332.
- ↑ Jost, A.; Rees, B.; Yelon, W. B. (1975-11-01). „Electronic structure of chromium hexacarbonyl at 78 K. I. Neutron diffraction study“. Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. International Union of Crystallography (IUCr). 31 (11): 2649–2658. doi:10.1107/s0567740875008394. ISSN 0567-7408.
- ↑ Finze, Maik; Bernhardt, Eduard; Willner, Helge; Lehmann, Christian W.; Aubke, Friedhelm (2005-05-10). „Homoleptic, σ-Bonded Octahedral Superelectrophilic Metal Carbonyl Cations of Iron(II), Ruthenium(II), and Osmium(II). Part 2: Syntheses and Characterizations of [M(CO)6][BF4]2 (M = Fe, Ru, Os)“. Inorganic Chemistry. American Chemical Society (ACS). 44 (12): 4206–4214. doi:10.1021/ic0482483. ISSN 0020-1669. PMID 15934749.
- ↑ Braga, Dario; Grepioni, Fabrizia; Orpen, A. Guy (1993). „Nickel carbonyl [Ni(CO)4] and iron carbonyl [Fe(CO)5]: molecular structures in the solid state“. Organometallics. American Chemical Society (ACS). 12 (4): 1481–1483. doi:10.1021/om00028a082. ISSN 0276-7333.
- ↑ Adams R. D., Barnard T. S., Cortopassi J. E., Wu W., Li Z. (1998). „Platinum-ruthenium carbonyl cluster complexes“. Inorganic Syntheses. Inorganic Syntheses. 32. стр. 280–284. doi:10.1002/9780470132630.ch44. ISBN 9780470132630.CS1-одржување: повеќе имиња: список на автори (link)
- ↑ Elliot. Band, E. L. Muetterties (1978). „Mechanistic features of metal cluster rearrangements“. Chem. Rev. 78 (6): 639–658. doi:10.1021/cr60316a003.
- ↑ Riedel, E.; Alsfasser, R.; Janiak, C.; Klapötke, T. M. (2007). Moderne Anorganische Chemie. de Gruyter. ISBN 978-3-11-019060-1.
- ↑ Henderson, W.; McIndoe, J. S. (2005-04-01). Mass Spectrometry of Inorganic, Coordination and Organometallic Compounds: Tools – Techniques – Tips. John Wiley & Sons. ISBN 978-0-470-85015-2.
- ↑ Butcher, C. P. G.; Dyson, P. J.; Johnson, B. F. G.; Khimyak, T.; McIndoe, J. S. (2003). „Fragmentation of Transition Metal Carbonyl Cluster Anions: Structural Insights from Mass Spectrometry“. Chemistry: A European Journal. 9 (4): 944–950. doi:10.1002/chem.200390116. PMID 12584710.
- ↑ Ricks, A.M.; Reed, Z.E.; Duncan, M.A. (2011). „Infrared spectroscopy of mass-selected metal carbonyl cations“. Journal of Molecular Spectroscopy (англиски). 266 (2): 63–74. Bibcode:2011JMoSp.266...63R. doi:10.1016/j.jms.2011.03.006. ISSN 0022-2852.
- ↑ Vásquez, G. B.; Ji, X.; Fronticelli, C.; Gilliland, G. L. (1998). „Human Carboxyhemoglobin at 2.2 Å Resolution: Structure and Solvent Comparisons of R-State, R2-State and T-State Hemoglobins“. Acta Crystallographica D. 54 (3): 355–366. doi:10.1107/S0907444997012250. PMID 9761903.
- ↑ Tielens, A. G.; Wooden, D. H.; Allamandola, L. J.; Bregman, J.; Witteborn, F. C. (1996). „The Infrared Spectrum of the Galactic Center and the Composition of Interstellar Dust“. The Astrophysical Journal. 461 (1): 210–222. Bibcode:1996ApJ...461..210T. doi:10.1086/177049. PMID 11539170.
- ↑ Xu, Y.; Xiao, X.; Sun, S.; Ouyang, Z. (1996). „IR Spectroscopic Evidence of Metal Carbonyl Clusters in the Jiange H5 Chondrite“ (PDF). Lunar and Planetary Science. 26: 1457–1458. Bibcode:1996LPI....27.1457X.
- ↑ Cody, G. D.; Boctor, N. Z.; Filley, T. R.; Hazen, R. M.; Scott, J. H.; Sharma, A.; Yoder, H. S. Jr. (2000). „Primordial Carbonylated Iron–Sulfur Compounds and the Synthesis of Pyruvate“. Science. 289 (5483): 1337–1340. Bibcode:2000Sci...289.1337C. doi:10.1126/science.289.5483.1337. PMID 10958777.
- ↑ Feldmann, J. (1999). „Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in Sewage Gas by using Cryotrapping Gas Chromatography Inductively Coupled Plasma Mass Spectrometry“. Journal of Environmental Monitoring. 1 (1): 33–37. doi:10.1039/A807277I. PMID 11529076.
- ↑ Jaouen, G., уред. (2006). Bioorganometallics: Biomolecules, Labeling, Medicine. Weinheim: Wiley-VCH. ISBN 978-3-527-30990-0.
- ↑ Boczkowski, J.; Poderoso, J. J.; Motterlini, R. (2006). „CO–Metal Interaction: Vital Signaling from a Lethal Gas“. Trends in Biochemical Sciences. 31 (11): 614–621. doi:10.1016/j.tibs.2006.09.001. PMID 16996273.
- ↑ Herrmann, W. A. (1988). „100 Jahre Metallcarbonyle. Eine Zufallsentdeckung macht Geschichte“. Chemie in unserer Zeit. 22 (4): 113–122. doi:10.1002/ciuz.19880220402.
- ↑ Huheey, J.; Keiter, E.; Keiter, R. (1995). „Metallcarbonyle“. Anorganische Chemie (2. изд.). Berlin / New York: de Gruyter.
- ↑ Mittasch, A. (1928). „Über Eisencarbonyl und Carbonyleisen“. Angewandte Chemie. 41 (30): 827–833. Bibcode:1928AngCh..41..827M. doi:10.1002/ange.19280413002.
- ↑ Miessler, Gary L.; Paul J. Fischer; Donald Arthur Tarr (2013). Inorganic Chemistry. Prentice Hall. стр. 696. ISBN 978-0321811059.
- ↑ Hieber, W.; Fuchs, H. (1941). „Über Metallcarbonyle. XXXVIII. Über Rheniumpentacarbonyl“. Zeitschrift für anorganische und allgemeine Chemie. 248 (3): 256–268. doi:10.1002/zaac.19412480304.
- ↑ King, R. B. (1965). Organometallic Syntheses. 1: Transition-Metal Compounds. New York: Academic Press.
- ↑ Braye, E. H.; Hübel, W.; Rausch, M. D.; Wallace, T. M. (1966). H. F. Holtzlaw (уред.). Diiron Enneacarbonyl. Inorganic Syntheses. 8. Hoboken, NJ: John Wiley & Sons. стр. 178–181. doi:10.1002/9780470132395.ch46. ISBN 978-0-470-13239-5.
- ↑ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (102nd. изд.). Berlin: de Gruyter. стр. 1780–1822. ISBN 978-3-11-017770-1.Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (102nd ed.). Berlin: de Gruyter. pp. 1780–1822. ISBN 978-3-11-017770-1.
- ↑ Girolami, G.S.; Rauchfuss, T.B.; Angelici, R.J. (1999). Synthesis and Technique in Inorganic Chemistry (3rd. изд.). Sausalito, CA: University Science Books. стр. 190. ISBN 0-935702-48-2.
- ↑ Roland, E.; Vahrenkamp, H. (1985). „Zwei neue Metallcarbonyle: Darstellung und Struktur von RuCo2(CO)11 und Ru2Co2(CO)13“. Chemische Berichte. 118 (3): 1133–1142. doi:10.1002/cber.19851180330.
- ↑ Pike, R. D. (2001). „Disodium Tetracarbonylferrate(−II)“. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rd465. ISBN 978-0471936237.
- ↑ Xu, Q.; Imamura, Y.; Fujiwara, M.; Souma, Y. (1997). „A New Gold Catalyst: Formation of Gold(I) Carbonyl, [Au(CO)n]+ (n = 1, 2), in Sulfuric Acid and Its Application to Carbonylation of Olefins“. Journal of Organic Chemistry. 62 (6): 1594–1598. doi:10.1021/jo9620122.
- ↑
Sillner, H.; Bodenbinder, M.; Brochler, R.; Hwang, G.; Rettig, S. J.; Trotter, J.; von Ahsen, B.; Westphal, U.; Jonas, V. (2001). „Superelectrophilic Tetrakis(carbonyl)palladium(II)- and platinum(II) Undecafluorodiantimonate(V), [Pd(CO)4][Sb2F11]2 and [Pt(CO)4][Sb2F11]2: Syntheses, Physical and Spectroscopic Properties, Their Crystal, Molecular, and Extended Structures, and Density Functional Theory Calculations: An Experimental, Computational, and Comparative Study“. Journal of the American Chemical Society. 123 (4): 588–602. doi:10.1021/ja002360s. PMID 11456571.
|hdl-access=бара|hdl=(help) - ↑ Malischewski, Moritz; Seppelt, Konrad; Sutter, Jörg; Munz, Dominik; Meyer, Karsten (2018). „A Ferrocene-Based Dicationic Iron(IV) Carbonyl Complex“. Angewandte Chemie International Edition (англиски). 57 (44): 14597–14601. doi:10.1002/anie.201809464. ISSN 1433-7851. PMID 30176109.
- ↑ Jim D. Atwood (1997). Inorganic and Organometallic Reaction Mechanisms (2. изд.). Wiley. ISBN 9780471188971.
- ↑ Ohst, H. H.; Kochi, J. K. (1986). „Electron-Transfer Catalysis of Ligand Substitution in Triiron Clusters“. Journal of the American Chemical Society. 108 (11): 2897–2908. doi:10.1021/ja00271a019.
- ↑ Wu, Xuan; Zhao, Lili; Jin, Jiaye; Pan, Sudip; Li, Wei; Jin, Xiaoyang; Wang, Guanjun; Zhou, Mingfei; Frenking, Gernot (2018-08-31). „Observation of alkaline earth complexes M(CO)8 (M = Ca, Sr, or Ba) that mimic transition metals“. Science (англиски). 361 (6405): 912–916. Bibcode:2018Sci...361..912W. doi:10.1126/science.aau0839. ISSN 0036-8075. PMID 30166489.
- ↑ Jin, Jiaye; Yang, Tao; Xin, Ke; Wang, Guanjun; Jin, Xiaoyang; Zhou, Mingfei; Frenking, Gernot (2018-04-25). „Octacarbonyl Anion Complexes of Group Three Transition Metals [TM(CO)8]− (TM = Sc, Y, La) and the 18-Electron Rule“. Angewandte Chemie International Edition (англиски). 57 (21): 6236–6241. doi:10.1002/anie.201802590. ISSN 1433-7851. PMID 29578636.
- ↑ Ellis, J. E. (2003). „Metal Carbonyl Anions: from [Fe(CO)4]2− to [Hf(CO)6]2− and Beyond“. Organometallics. 22 (17): 3322–3338. doi:10.1021/om030105l.
- ↑ Brathwaite, Antonio D.; Maner, Jonathon A.; Duncan, Michael A. (2013). „Testing the Limits of the 18-Electron Rule: The Gas-Phase Carbonyls of Sc+ and Y+“. Inorganic Chemistry (англиски). 53 (2): 1166–1169. doi:10.1021/ic402729g. ISSN 0020-1669. PMID 24380416.
- ↑ Finze, M.; Bernhardt, E.; Willner, H.; Lehmann, C. W.; Aubke, F. (2005). „Homoleptic, σ-Bonded Octahedral Superelectrophilic Metal Carbonyl Cations of Iron(II), Ruthenium(II), and Osmium(II). Part 2: Syntheses and Characterizations of [M(CO)6][BF4]2 (M = Fe, Ru, Os)“. Inorganic Chemistry. 44 (12): 4206–4214. doi:10.1021/ic0482483. PMID 15934749.
- ↑ Lubbe, Stephanie C. C.; Vermeeren, Pascal; Fonseca Guerra, Célia; Bickelhaupt, F. Matthias (2020). „The Nature of Nonclassical Carbonyl Ligands Explained by Kohn–Sham Molecular Orbital Theory“. Chemistry – A European Journal. 26 (67): 15690–15699. doi:10.1002/chem.202003768. PMC 7756819 Проверете ја вредноста
|pmc=(help). PMID 33045113 Проверете ја вредноста|pmid=(help). - ↑ Fairweather-Tait, S. J.; Teucher, B. (2002). „Iron and Calcium Bioavailability of Fortified Foods and Dietary Supplements“. Nutrition Reviews. 60 (11): 360–367. doi:10.1301/00296640260385801. PMID 12462518.
- ↑ Richardson, D. (2002). Stealth-Kampfflugzeuge: Täuschen und Tarnen in der Luft. Zürich: Dietikon. ISBN 978-3-7276-7096-1.
- ↑ Wilke, G. (1978). „Organo Transition Metal Compounds as Intermediates in Homogeneous Catalytic Reactions“ (PDF). Pure and Applied Chemistry. 50 (8): 677–690. doi:10.1351/pac197850080677.
- ↑ Hartwig, John (2010). Organotransition Metal Chemistry: From Bonding to Catalysis. New York: University Science Books. стр. 1160. ISBN 978-1-938787-15-7.
- ↑ Motterlini Roberto, Otterbein Leo (2010). „The therapeutic potential of carbon monoxide“. Nature Reviews Drug Discovery. 9 (9): 728–43. doi:10.1038/nrd3228. PMID 20811383.
- ↑ Hayton, T. W.; Legzdins, P.; Sharp, W. B. (2002). „Coordination and Organometallic Chemistry of Metal−NO Complexes“. Chemical Reviews. 102 (4): 935–992. doi:10.1021/cr000074t. PMID 11942784.
- ↑ Petz, W. (2008). „40 Years of Transition-Metal Thiocarbonyl Chemistry and the Related CSe and CTe Compounds“. Coordination Chemistry Reviews. 252 (15–17): 1689–1733. doi:10.1016/j.ccr.2007.12.011.
- ↑ Hill, A. F.; Wilton-Ely, J. D. E. T. (2002). Chlorothiocarbonyl-bis(triphenylphosphine) iridium(I) [IrCl(CS)(PPh3)2]. Inorganic Syntheses. 33. стр. 244–245. doi:10.1002/0471224502.ch4. ISBN 978-0-471-20825-9.
- ↑ Clark, George R.; Marsden, Karen; Roper, Warren R.; Wright, L. James (1980). „Carbonyl, Thiocarbonyl, Selenocarbonyl, and Tellurocarbonyl Complexes Derived from a Dichlorocarbene Complex of Osmium“. Journal of the American Chemical Society. 102 (3): 1206–1207. doi:10.1021/ja00523a070.
- ↑ D. Lentz (1994). „Fluorinated Isocyanides - More than Ligands with Unusual Properties“. Angewandte Chemie International Edition in English. 33 (13): 1315–1331. doi:10.1002/anie.199413151.
- ↑ Madea, B. (2003). Rechtsmedizin. Befunderhebung - Rekonstruktion – Begutachtung. Springer-Verlag. ISBN 978-3-540-43885-4.
- ↑ Stellman, J. M. (1998). Encyclopaedia of Occupational Health and Safety. International Labour Org. ISBN 978-91-630-5495-2.
- ↑ Mehrtens, G.; Reichenbach, M.; Höffler, D.; Mollowitz, G. G. (1998). Der Unfallmann: Begutachtung der Folgen von Arbeitsunfällen, privaten Unfällen und Berufskrankheiten. Berlin / Heidelberg: Springer. ISBN 978-3-540-63538-3.
- ↑ Trout, W. E. Jr. (1937). „The Metal Carbonyls. I. History; II. Preparation“. Journal of Chemical Education. 14 (10): 453. Bibcode:1937JChEd..14..453T. doi:10.1021/ed014p453.
- ↑ Schützenberger, P. (1868). „Mémoires sur quelques réactions donnant lieu à la production de l'oxychlorure de carbone, et sur nouveau composé volatil de platine“. Bulletin de la Société Chimique de Paris. 10: 188–192.
- ↑ Mond, L.; Langer, C.; Quincke, F. (1890). „Action of Carbon Monoxide on Nickel“. Journal of the Chemical Society, Transactions. 57: 749–753. doi:10.1039/CT8905700749.
- ↑ Gratzer, W. (2002). „132: Metal Takes Wing“. Eureka and Euphorias: The Oxford Book of Scientific Anecdotes. Oxford University Press. ISBN 978-0-19-280403-7.
- ↑ Mond, L.; Hirtz, H.; Cowap, M. D. (1908). „Note on a Volatile Compound of Cobalt with Carbon Monoxide“. Chemical News. 98: 165–166.
- ↑ Chemical Abstracts. 2: 3315. 1908. Отсутно или празно
|title=(help) - ↑ Dewar, J.; Jones, H. O. (1905). „The Physical and Chemical Properties of Iron Carbonyl“. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 76 (513): 558–577. Bibcode:1905RSPSA..76..558D. doi:10.1098/rspa.1905.0063.
- ↑ Basolo, F. (2002). From Coello to Inorganic Chemistry: A Lifetime of Reactions. Springer. стр. 101. ISBN 978-030-646774-5.
- ↑ Sheldon, R. A., уред. (1983). Chemicals from Synthesis Gas: Catalytic Reactions of CO and H2. 2. Kluwer. стр. 106. ISBN 978-9027714893.
- ↑ Hoffmann, R. (1981-12-08). „Building Bridges between Inorganic and Organic Chemistry“. Nobelprize.org.
- ↑ Tard, C; Pickett, C. J. (2009). „Structural and Functional Analogues of the Active Sites of the [Fe]-, [NiFe]-, and [FeFe]-Hydrogenases“. Chemical Reviews. 109 (6): 2245–2274. doi:10.1021/cr800542q. PMID 19438209.
Надворешни врски[уреди | уреди извор]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||