Калај(II) оксид
| |

| |

| |
Назив според МСЧПХ Калај(II) оксид | |
Други називи Стан оксид, Калај моноксид | |
| Назнаки | |
|---|---|
| 21651-19-4 | |
| EC-број | 244-499-5 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 88989 |
| RTECS-бр. | XQ3700000 |
| |
| UNII | JB2MV9I3LS |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | црн или црвен прав кога е безводен, бел кога е хидриран |
| Густина | 6,45 g/cm3 |
| Точка на топење | |
| нерастворлив | |
| −19,0·10−6 cm3/mol | |
| Структура | |
| Кристална структура | тетрагонал |
| Термохемија | |
| Ст. енталпија на формирање ΔfH |
−285 kJ·mol−1[1] |
| Стандардна моларна ентропија S |
56 J·mol−1·K−1[1] |
| Опасност | |
| Температура на запалување | {{{value}}} |
| NIOSH (здравствени граници во САД): | |
PEL (дозволива)
|
0[2] |
REL (препорачана)
|
TWA 2 mg/m3[2] |
IDLH (непосредна опасност)
|
N.D.[2] |
| Безбедносен лист | ICSC 0956 |
| Слични супстанци | |
| Други анјони | Tin sulfide Tin selenide Tin telluride |
| Други катјони | Carbon monoxide Silicon monoxide Germanium(II) oxide Lead(II) oxide |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Калај(II) оксид (стан оксид) е соединение со формулата SnO. Составен е од калај и кислород каде што калајот има состојба на оксидација од +2. Постојат две форми, стабилна сино-црна форма и метастабилна црвена форма.
Подготовка и реакции[уреди | уреди извор]

Сино-црниот SnO може да се произведе со загревање на калај (II) оксид хидрат, каде SnO·xH2O (x<1) се таложи кога солта на калај(II) ќе реагира со алкален хидроксид како на пр. NaOH.[3]
Метастабилниот, црвен SnO може да се подготви со нежно загревање на талогот произведен од дејството на воден амонијак на калај(II) солта.[3]
SnO може да се подготви како чиста супстанција во лабораторија, со контролирано загревање на калај(II) оксалат (стан оксалат) во отсуство на воздух или под CO2 атмосфера. Овој метод се применува и за производство на железен оксид и манган оксид.[4][5]
- SnC2O4·2H2O → SnO + CO2 + CO + 2 H2O
Калај (II) оксид гори во воздух со слаб зелен пламен за да формира SnO2.[3]
- 2 SnO + O2 → 2 SnO2
Кога се загрева во инертна атмосфера првично се јавува диспропорционално давајќи Sn метал и Sn3O4 што дополнително реагира и дава SnO2 и Sn метал.[3]
- 4SnO → Sn3O4 + Sn
- Sn3O4 → 2SnO2 + Sn
SnO е амфотеричен, се раствора во силна киселина за да се добијат калај(II) соли и во силна база за да се добијат станити кои содржат Sn(OH).3-.[3] Може да се раствори во раствори на силна киселина за да се добијат јонските комплекси Sn(OH2)32+ и Sn(OH)(OH< sub>2)2+, а во раствори со послаби киселини се добива Sn3(OH)42+.[3] Забележете дека безводните станити, на пр. K2Sn2O3, K2SnO2 се исто така познати.[6][7][8] SnO е редукционо средство и се смета дека го редуцира бакарот(I) во метални кластери во производството на таканареченото „бакарно рубин стакло“.[9]
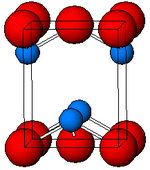
Структура[уреди | уреди извор]
Црниот, α-SnO ја прифаќа тетрагоналната структура на слојот PbO која содржи четири координатни квадратни пирамидални атоми на калај.[10] Оваа форма се наоѓа во природата како редок минерал ромархит.[11] Асиметријата обично едноставна и се припишува на стерично активенот пар; сепак, пресметките на густината на електроните покажуваат дека асиметријата е предизвикана од антиврзувачка интеракција на орбиталите Sn(5s) и O(2p).[12] Електронската структура и хемијата на активниот пар ги одредуваат повеќето својства на материјалот.[13]
Не-стехиометрија е забележана кај SnO.[14]
Електронскиот јаз на опсегот е измерен помеѓу 2,5eV и 3eV.[15]
Употреба[уреди | уреди извор]
Доминантната употреба на калај оксидот е како претходник во производството на други, типично двовалентни, калајни соединенија или соли. Стан оксидот, исто така, може да се користи како средство за намалување и во создавањето на стакло од рубин.[16] It has a minor use as an esterification catalyst.
Цериум(III) оксидот во керамичка форма, заедно со калај(II) оксид (SnO) се користи за осветлување со УВ светлина.[17]
Наводи[уреди | уреди извор]
- ↑ 1,0 1,1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. стр. A23. ISBN 978-0-618-94690-7.
- ↑ 2,0 2,1 2,2 „Џебен водич за опасните хемиски материи #0615“. Национален институт за безбедност и здравје при работа (NIOSH). (англиски)
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ↑ Satya Prakash (2000),Advanced Inorganic Chemistry: V. 1, S. Chand, ISBN 81-219-0263-0
- ↑ Arthur Sutcliffe (1930) Practical Chemistry for Advanced Students (1949 Ed.), John Murray - London.
- ↑ Braun, Rolf Michael; Hoppe, Rudolf (1978). „The First Oxostannate(II): K2Sn2O3“. Angewandte Chemie International Edition in English. 17 (6): 449–450. doi:10.1002/anie.197804491.
- ↑ Braun, R. M.; Hoppe, R. (1982). „Über Oxostannate(II). III. K2Sn2O3, Rb2Sn2O3 und Cs2Sn2O3 - ein Vergleich“. Zeitschrift für Anorganische und Allgemeine Chemie. 485: 15–22. doi:10.1002/zaac.19824850103.
- ↑ R M Braun R Hoppe Z. Naturforsch. (1982), 37B, 688-694
- ↑ Bring, T.; Jonson, B.; Kloo, L.; Rosdahl, J; Wallenberg, R. (2007), „Colour development in copper ruby alkali silicate glasses. Part I: The impact of tin oxide, time and temperature“, Glass Technology, Eur. J. Glass Science & Technology, Part A, 48 (2): 101–108, ISSN 1753-3546
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Ramik, R. A.; Organ, R. M.; Mandarino, J. A. (2003). „On Type Romarchite and Hydroromarchite from Boundary Falls, Ontario, and Notes on Other Occurrences“. The Canadian Mineralogist. 41 (3): 649–657. doi:10.2113/gscanmin.41.3.649.
- ↑ Walsh, Aron; Watson, Graeme W. (2004). „Electronic structures of rocksalt, litharge, and herzenbergite SnO by density functional theory“. Physical Review B. 70 (23): 235114. Bibcode:2004PhRvB..70w5114W. doi:10.1103/PhysRevB.70.235114.
- ↑ Mei, Antonio B.; Miao, Ludi; Wahila, Matthew J.; Khalsa, Guru; Wang, Zhe; Barone, Matthew; Schreiber, Nathaniel J.; Noskin, Lindsey E.; Paik, Hanjong; Tiwald, Thomas E.; Zheng, Qiye (2019-10-21). „Adsorption-controlled growth and properties of epitaxial SnO films“. Physical Review Materials. 3 (10): 105202. Bibcode:2019PhRvM...3j5202M. doi:10.1103/PhysRevMaterials.3.105202. S2CID 208008118.
- ↑ Moreno, M. S.; Varela, A.; Otero-Díaz, L. C. (1997). „Cation nonstoichiometry in tin-monoxide-phaseSn1−δOwith tweed microstructure“. Physical Review B. 56 (9): 5186–5192. doi:10.1103/PhysRevB.56.5186.
- ↑ Science and Technology of Chemiresistor Gas Sensors By Dinesh K. Aswal, Shiv K. Gupta (2006), Nova Publishers, ISBN 1-60021-514-9
- ↑ "Red Glass Coloration - A Colorimetric and Structural Study" By Torun Bring. Pub. Vaxjo University.
- ↑ Peplinski, D.R.; Wozniak, W.T.; Moser, J.B. (1980). „Spectral Studies of New Luminophors for Dental Porcelain“ (PDF). Journal of Dental Research. Jdr.iadrjournals.org. 59 (9): 1501–1506. doi:10.1177/00220345800590090801. PMID 6931128. S2CID 20191368. Посетено на 2012-04-05.[мртва врска]
| ||||||||||
