Идиопатска пулмонална фиброза (ИПФ)
| Идиопатска белодробна фиброза | |
|---|---|
| Синоними | Криптогенски фиброзен алвеолит, дифузен фиброзен алвеолит, вообичаен интерстицијален пневмонит [1] |
 | |
| На слика A е прикажана местоположбата на белите дробови и дишните патишта во телото. На исечокот е даден детален приказ на белодробните дишни патишта и пресен на воздушните кеси. На слика B е прикажана фиброза (лузни) во белите дробови. На исечокот е даден детален приказ на фиброза и како таа ги оштетува дишните патишта и воздушните кеси.[1] | |
| Специјалност | Пулмологија |
| Симптоми | Отежнато дишење, сува кашлица[1] |
| Компликации | Пулмонална хипертензија, срцева слабост, пневмонија, белодробна емболија[1] |
| Вообичаена појава | постепено[1] |
| Причинители | непознати[2] |
| Ризик-фактори | Тутунопушење, некои вирусни инфекции, семејна историја[1] |
| Дијагностички метод | Компјутеризирана томографија, белодробна биопсија[3] |
| Диференцијална дијагноза | Саркоидоза, други интерстицијални белодробни болести, пречувствителен пневмонит[4] |
| Третман | Пулмонална рехабилитација, оксигенотерапија, белодробно пресадување[1] |
| Лекови | Пирфенидон, нинтеданиб[2] |
| Прогноза | Продолжителност на животот ~ 4 години[1] |
| Честота | 12 на 100.000 жители годишно[4] |
Идиопатска пулмонална фиброза (ИПФ) или идиопатска белодробна фиброза (ИБФ) — ретко, иреверзибилно и смртоносно заболување кое предизвикува трајно оштетување на белите дробови преку прогресивно создавање на лузни (сврзно ткиво).
Претставува посмртоносна болест од повеќето видови на злоќудни болести, вклучувајќи рак на дојка, рак на простата, некои форми на леукемија и лимфом. Во просек, половина од лицата со ИПФ живеат од 2 до 5 години откога ќе се потврди дијагнозата. Една неодамнешна студија која ги споредува ИПФ со одредени видови на злоќудни болести покажала дека само пациентите со рак на бели дробови и рак на панкреас имаат полоша стапка на преживување.
При ИПФ се создаваат лузни на ткивото на белите дробови кои ги спречуваат белите дробови да работат правилно, спречувајќи ги да се прошират колку што е потребно, со што се намалува количината на кислород кој влегува во крвотокот. Ова предизвикува функционално оштетување и попреченост.
Знаци и симптоми[уреди | уреди извор]
Како што се шират лузните во белите дробови, дишењето станува сè потешко. Многу вообичаени дневни активности стануваат потешки, или дури невозможни.
Раните знаци и симптоми на ИПФ обично вклучуваат:
- кашлица која не поминува;
- недостаток на здив при вршење секојдневни физички активности како што се качување скали и на крајот, дури и при одмор;
- билатерални инспираторни кркори слушнати при аускултација на градите, кои биле опишани како „велкро звуци“;
Доцните симптоми на ИПФ може да вклучуваат:
- недостаток на здив и/или кашлица при одмор, кои влијаат врз рутинските секојдневни активности како што се: јадење, разговор по телефон или туширање.
Неконтролираните симптоми како кашлица се срамни и вознемирувачки и често ги спречува луѓето со ИПФ да прават работи што ги сакаат. Напредувањето на ИПФ е различно кај секој пациент. Некои доживуваат брза прогресија и „напади на белите дробови" што доведуваат до хоспитализација. Други, ако започнат со третман веднаш по поставување на дијагнозата живеат многу подолго со помал број на влошувања и потреба за хоспитализација. ИПФ главно ги зафаќа белите дробови, но на крајот може да доведе до срцева слабост или да има сериозни ефекти врз другите витални органи.
Причини[уреди | уреди извор]
Причината за ИПФ сè уште не е позната; но сепак, некои докази сугерираат дека генетските фактори може да имаат улога во развојот, а 5% од пациентите со ИПФ имаат членови на семејството со оваа болест. Други ризични фактори вклучуваат:
• пушење (сегашно или минато); • професионална изложеност на одредени видови прашина; • вирусни инфекции; • гастроезофагеална рефлуксна болест; • фактори на околината;
Патогенеза[уреди | уреди извор]
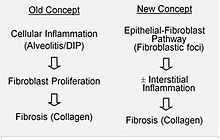
И покрај обемната истрага, причината за ИПФ останува непозната.[3] Фиброзата кај ИПФ е поврзана со пушење цигари, фактори на животната средина (на пр., професионална изложеност на гасови, чад, хемикалии или прашина), други медицински состојби, вклучително и гастроезофагеална рефлуксна болест (ГЕРД) или генетска склоност (семејна ИПФ). Сепак, ниту едно од овие не е присутно кај сите лица со ИПФ и затоа не даваат целосно задоволително објаснување за болеста.
ИПФ се верува дека е резултат на непостојан процес на заздравување на раните, вклучувајќи / абнормално и прекумерно таложење на колаген (фиброза) во пулмоналниот интерстициум со минимално поврзано воспаление.[5]
Се претпоставува дека почетната или повторувачката повреда кај ИПФ се јавува кај клетките на белите дробови, наречени алвеоларни епителни клетки (АЕК, пневмоцити), кои ја насочуваат поголемиот дел од алвеоларната површина.[6] Кога АЕК од типот I се оштетени или изгубени, се смета дека АЕК од типот II се подложени на пролиферација за да се покријат изложените подрумски мембрани. При нормална поправка, хиперпластичните типови АЕК II умираат, а преостанатите клетки се шират и поминуваат низ процес на диференцијација за да станат АЕК од типот I. Под патолошки услови и во присуство на трансформативен фактор на раст бета (ТФР), фибробластите се акумулираат во овие области на оштетување и се разликуваат во миофибробластите што лачат колаген и други белковини. Во минатото, се сметало дека воспалението е првиот настан при иницирање на лузни на ткивото на белите дробови. Подоцнежните откритија покажаа дека развојот на фибробластични фокуси претходи на акумулација на воспалителни клетки и последователно таложење на колаген.[7] Овој патогенетски модел индиректно е поддржан од клиничките одлики на ИПФ, вклучувајќи подмолен почеток во текот на неколку години, релативно ретки акутни егзацербации и неуспехот да се одговори на имуносупресивната терапија.[5][8] Голем број на терапии кои имаат за цел активирање на фибробласт или синтеза на вонклеточна матрица во моментот се на почетокот на тестирањето или се разгледуваат за развој.
Семејната ИПФ е помалку од 5% од вкупниот број пациенти со ИПФ и клинички и хистолошки не се разликува од спорадична ИПф.[3] Генетските асоцијации вклучуваат мутации во белодробни сурфактанти белковини А1, А2, Ц (СФTПA1, СФTПA2Б) и муцин (МУЦ5Б).[9] Забележителен аспект на варијантата МУК5Бенеговата висока честота на откривање, бидејќи се наоѓа кај приближно 20% од лицата со потекло од Северна и Западна Европа и во 19% од популацијата на студијата за срцето Фрамингам.[10] Мутациите кај гените кај човечка телемераза се исто така поврзани со семејна белодробна фиброза и кај некои пациенти со спорадична ИПФ (на пр. Гените ТЕРТ, ТЕРК ). Неодамна, мултиповрзана мутација во трет ген поврзан со телемераза, дискерин (ДКК1), е опишана во семејство со ИПФ.[11] [ <span title="Material near this tag may rely on an unreliable or less reliable medical source. (June 2019)">несигурен медицински извор?</span>
Дијагноза[уреди | уреди извор]
Важно е да се потврди дијагнозата на ИПФ што е можно порано, така што третманот на состојбата може да започне веднаш; ова може да има сигнификантно влијание како прогредира ИПФ.
Постојаната кашлица и карактеристичните кркори при дишење поврзани со болеста често не се препознаваат како ИПФ. Половина од луѓето со ИПФ првично погрешно се дијагностицираат, бидејќи симптомите често се мешаат со други белодробни или срцеви болести, како што се астма, ХОББ или срцева слабост.
Поставувањето дијагноза вклучува исклучување на сите други познати причини за фиброзно заболување на белите дробови и може да вклучи едно или повеќе од следниве:
- медицинска историја и физички преглед;
- рентген на градите;
- тестови за дишење;
- компјутеризирана томографија ;
- биопсија на белите дробови;
- бронхоскопија;
За половина од пациентите со ИПФ, потребно е најмалку една година за да се добие точна дијагноза. Ова е критичен период бидејќи, без третман, болеста се влошува со текот на времето и може брзо да напредува.
Диференцијална дијагноза[уреди | уреди извор]
Признавањето на ИПФ во клиничката пракса може да биде предизвикувачко бидејќи симптомите честопати се појавуваат слични на оние на почестите заболувања, како што се астма, хронично опструктивно белодробно заболување (ХОБЗ) и конгестивна срцева слабост (КСС) Клучното прашање со кои се соочуваат клиничарите е дали презентирањето на историјата, симптомите (или знаците), радиологијата и тестирањето на белодробната функција се колективно во согласност со дијагнозата на ИПФ или дали наодите се резултат на друг процес. Одамна е признаено дека пациентите со ИЛД поврзани со изложеност на азбест, лекови (како што се хемотерапевтски агенси или нитрофурантоин ), ревматоиден артритис и склеродерма / системска склероза може да биде тешко да се разликуваат од ИПФ. Други диференцијални дијагностички размислувања вклучуваат интерстицијална белодробна болест поврзана со мешано заболување на сврзно ткиво, напредна саркоидоза, хронична хиперсензитивност, пневмонитис, пулмонална хистиоцитоза на Лангерханска клетка и повреда на белите дробови предизвикана од зрачење.[3][12]
Класификација[уреди | уреди извор]

Идиопатска пулмонална фиброза (ИПФ) припаѓа на голема група од повеќе од 200 заболувања на белите дробови, познати како интерстицијални заболувања на белите дробови (ИЛД), кои се одликуваат со вклучување на белодробниот интерстиција,[12] ткиво помеѓу воздушните кеси на белите дробови. ИПФ е една специфична презентација на идиопатска интерстицијална пневмонија (ИИП), која е пак еден вид на ИЛД, исто така позната како дифузна паренхимска болест на белите дробови (ДПББД).
Класификацијата на ИИП на Американското торакално друштво / Европско респираторно општество (АТД / ЕРО) била ажурирана во 2013 година.[12] Во оваа нова класификација има три главни категории на идиопатски интерстицијални пневмонија (ИИП): главни ИИП, ретки ИИП и некласибилни ИИП. Главните ИИП се групирани во хронични фиброзни ИП (ова вклучува ИПФ и неспецифична интерстицијална пневмонија [НИП]); ИП-адреси поврзани со пушењето (т.е. респираторен бронхиолитис - интерстицијална белодробна болест [РБ-ИББ] и десквамативна интерстицијална пневмонија [ДИП]); и акутни / субакутни IP-адреси (т.е. криптогено организирање на пневмонија [КОП] и акутна интерстицијална пневмонија [АИП]).
Дијагнозата на ИИП бара исклучување на познати причини за ИЛД. Примери на ИЛД на позната причина се хиперсензитивност пневмонитис, пулмонална хистиоцитоза на лангеранскиот клетки, азбест и колаген васкуларна болест. Сепак, овие нарушувања честопати влијаат не само на интерстистиумот, туку и на воздушните места, периферните дишни патишта и крвните садови.[12]
Радиологија[уреди | уреди извор]
Х-зраци на градниот кош се корисни во рутината што следи на пациенти со ИПФ. Обичните Х-зраци на градниот кош, за жал, не се дијагностички, но може да откријат намален волумен на белите дробови, обично со истакнати ретикуларни интерстицијални ознаки во близина на подножјето на белите дробови.[3]

Радиолошката проценка преку ХРКТ е суштинска точка во дијагностичката патека на ИПФ. ХРКТ се изведува со употреба на конвенционален компјутерски осен томографски скенер, без инјектирање на агенси за контраст. Парчињата за евалуација се многу тенки, 1-2 мм.
Типичен ХРКТ на градниот кош на ИПФ демонстрира фибротични промени кај обете бели дробови, со склоност за основите и периферијата. Според заедничките упатства АТС / ЕРС / ЈРС / АЛАТ 2011, ХРКТ е суштинска компонента на дијагностичката патека кај ИПФ која може да го идентификува ВИП со присуство на:[3]
- Ретикуларни заматувања, честопати поврзани со влечење бронхиектазии
- Саќето што се манифестира како манипуларен цистичен воздушен простор, обично со пречник од 3 до 10 мм, но повремено и поголеми. Вообичаено е потплеврален и се одликува со добро дефинирани sидови кои се поставени во најмалку два реда. Општо, една линија цисти не е доволна за да се дефинира саќето.
- Симптомот на матно стакло е вообичаен, но помалку екстензивен од ретикулацијата
- Дистрибуцијата е карактеристично базална и периферна, иако честопати неподвижна.

Хистологија[уреди | уреди извор]
Според ажурираните упатства за 2011 година, во отсуство на типична ВИП шема на ХРЦТ, потребна е хируршка биопсија на белите дробови за самоуверена дијагноза.[3]
Хистолошките примероци за дијагностицирање на ИПФ мора да бидат земени барем на три различни места и да бидат доволно големи што патологот може да ја коментира основната архитектура на белите дробови. Малите биопсии, како оние што се добиени преку трансбронхијална биопсија на белите дробови (изведени за време на бронхоскопија) обично не се доволни за оваа намена. Оттука, обично се потребни поголеми биопсии добиени хируршки преку торакотомија или торакоскопија.[3][12]
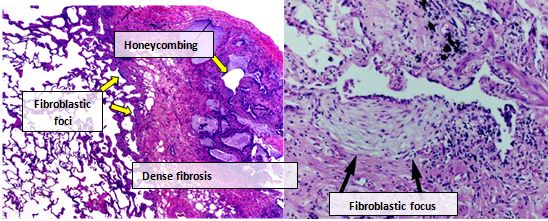
Ткивото на белите дробови кај луѓе со ИПФ обично покажува карактеристична хистопатолошка ВИП шема и затоа е патолошки пандан на ИПФ.[3] Иако патолошка дијагностика на ВИП често одговара на клиничка дијагноза на ИПФ, хистолошка шема на ВИП може да се забележи и кај други болести, како и фиброза со познато потекло (ревматски заболувања).[1] Постојат четири клучни одлики на ВИП, вклучително интерстицијална фиброза во „шема на крпеница“, интерстицијални лузни, промени во саќе и фокуси на фибробласт.
Фибробластичните фокуси се густи збирки на миофибробласти и ткиво на лузни и, заедно со саќето, се главните патолошки наоди кои овозможуваат дијагностицирање на ВИП.
Бронхоалвеоларна лаважа[уреди | уреди извор]
Бронхоалвеоларна лаважа (БАЛ) е добро толерирана дијагностичка процедура за ИЛД.[13] Анализата на цитологијата на БАЛ (броеви на диференцијални клетки) треба да се земат предвид при проценката на пациенти со ИПФ по дискреција на лекарот што лекува врз основа на достапност и искуство во нивната институција. БАЛ може да открие алтернативни специфични дијагностици: злоќуднитет, инфекции, еозинофилна пневмонија, хистиоцитоза X или алвеоларна протеиноза. Во проценката на пациенти со сомнителен ИПФ, најважната примена на БАЛ е во исклучување на други дијагностици. Истакната лимфоцитоза (30%) генерално овозможува исклучување на дијагнозата на ИПФ.[14]
Тестови за белодробна функција[уреди | уреди извор]
Спирометријата класично открива намалување на виталниот капацитет (ВК) со или пропорционално намалување на протоците на воздух, или зголемено проток на воздух за набудуваниот витален капацитет. Последниот наод се одразува на зголемената вкочанетост на белите дробови (намалена усогласеност на белите дробови) поврзана со белодробна фиброза, што доведува до зголемена еластична поврат на белите дробови.[15]
Мерењето на статички волумен на белите дробови со помош на телесна плеографија или други техники обично открива намален обем на белите дробови (ограничување). Ова ја отсликува тешкотијата што се среќава при надувување на фибротичните бели дробови.
Капацитетот за дифузија за јаглерод моноксид е намален кај ИПФ и може да биде единствената абнормалност кај блага или рана болест. Неговото оштетување е во основата на склоноста на пациентите со ИПФ да покажат хеморизација на кислород со вежбање, кое исто така може да се процени со помош на тест од 6 минути пешачење.[3]
Поими како што се „благи“, „умерени“ и „тешки“ понекогаш се користат за поставување на болести и обично се засноваат на мерења на белодробна функција за одмор.[3] Сепак, не постои јасен консензус во врска со поставувањето на ИПФ пациенти и кои се најдобрите критериуми и вредности што треба да се користат. Блага до умерена ИПФ се одликува со следниве функционални критериуми:[16][17][18][19]
- Присилен витален капацитет (ФВК) од 50%
- Дифузен капацитет на белите дробови на јаглерод моноксид од 30%
- 6-минутно пешачење на растојание ≥150 метри.
Третман[уреди | уреди извор]
60% од лицата со дијагностицирана ИПФ не започнуваат со третман веднаш, или не го добиваат најдобриот третман кој е на располагање. Пациентите кои најверојатно ќе добијат третман за ИПФ се обично оние во подоцнежните фази на болеста чија функција на белите дробови и квалитетот на животот веќе се сериозно нарушени.
Во моментов, единствен лек за ИПФ е пресадување на бели дробови, но помалку од 5% од пациентите се пресадуваат, а исходот од пресадувањето кај ИПФ е далеку полош во споредба со другите болести.
До 2011 година, немало одобрени лекови за пациентите со ИПФ. Денес за среќа постои лек кој е достапен и во нашата држава кој има за цел да ги намали симптомите и да гозабави влошувањето на болеста, давајќи им на луѓето со ИПФ можност да ја одржат независноста и да прават што сакаат подолго време.
Терапија со кислород[уреди | уреди извор]
Во упатствата за ИПФ за 2011 година, терапијата со кислород или дополнителниот кислород за домашна употреба стана силна препорака за употреба кај оние пациенти со значително ниско ниво на кислород во мирување. Иако терапијата со кислород не се покажа дека го подобрува опстанокот на ИПФ, некои податоци укажуваат на подобрување на капацитетот за вежбање.[3][20]
Белодробна рехабилитација[уреди | уреди извор]
Замор и губење на мускулна маса се вообичаени и оневозможувачки проблеми за пациенти со ИПФ. Белодробната рехабилитација може да ги ублажи очигледните симптоми на ИПФ и да го подобри функционалниот статус со стабилизирање и / или враќање на екстрапулмонарните одлики на болеста.[21][22] Бројот на објавени студии за улогата на белодробна рехабилитација во идиопатска пулмонална фиброза е мал, но повеќето од овие студии откриле значителни краткорочни подобрувања во функционалната толеранција на вежбање, квалитетот на животот и диспнејата при напор.[23] Типични програми за рехабилитација вклучуваат обука на вежби, модулации во исхраната, професионална терапија, образование и психосоцијално советување. Во доцната фаза на заболување, пациентите со ИПФ имаат тенденција да ја прекинат физичката активност заради зголемена диспнеја. Кога и да е можно, ова треба да се обесхрабри.
Лекови[уреди | уреди извор]
Во минатото се испитувани бројни третмани за ИПФ, вклучувајќи интерферон гама-1б,[24] бозентан,[25] амбрисентан,[26] и антикоагуланси,[27] но тие веќе не се сметаат за ефикасни опции за третман. Многу од овие претходни студии биле засновани на хипотезата дека ИПФ е воспалително нарушување.
Пирфенидон[уреди | уреди извор]
Прегледот на Кохрана споредувајќи го пирфенидон со плацебо, открил намален ризик од прогресија на болести за 30%.[28] ФВК или ВК, исто така, се подобри, дури и ако благо забавување на падот на ФВК може да се покаже само во една од двете испитувања за КАПАЦИТЕТ.[16] Третата студија, која била завршена во 2014 година, открива намален пад на функцијата на белите дробови и прогресија на болеста на ИПФ.[18] Податоците од студијата АСЦЕНД биле исто така заедно со податоци од двете студии на КАПАЦИТЕТ во претходно утврдена анализа, која покажала дека пирфенидон го намалил ризикот од смрт за скоро 50% во текот на една година од третманот.
Н-ацетилцистеин и тројна терапија[уреди | уреди извор]
Н- ацетилцистеин (НАК) е претходник на глутатион, антиоксиданс. Се претпоставува дека третманот со високи дози на НАК може да поправи оксидансно-антиоксидансна нерамнотежа што се јавува во белодробното ткиво кај пациенти со ИПФ. Во првото клиничко испитување на 180 пациенти (ИФИГЕНИЈА), во претходната студија било прикажано НАК за да се намали падот на ВЦ и ДЛЦО во текот на 12 месеци последователно следење кога се користел во комбинација со преднизон и азатиоприн (тројна терапија).[29]
Неодамна, Националното Институт за Здравје (НИЗ) во САД презеде големо рандомизирано контролирано испитување ИПФ за проценка на тројна терапија и НАЦ монотерапија кај ИПФ пациенти. Оваа студија открила дека комбинацијата на преднизон, азатиоприн и НАК го зголемил ризикот од смрт и хоспитализација[30] а НИХ во 2012 година објавил дека раката со тројна терапија на студијата ИПФ е рано прекината.[31]
Оваа студија, исто така, го оцени НАЦ сам и резултатите за оваа рака на студијата биле објавени во мај 2014 година во ново списание за медицина во Англија, заклучувајќи дека „споредено со плацебо, ацетилцистеинот не понудил значителна корист во однос на зачувувањето на ФВЦ кај пациенти со идиопатска пулмонална фиброза со благо до умерено нарушување во функцијата на белите дробови”.[32]
Нинтендиб[уреди | уреди извор]
Нинтендиб е троен инхибитор на ангиокиназа кој цели кон рецепторот тирозин кинази вклучен во регулирањето на ангиогенезата: рецептор на факторот на раст на фибробласт (РФРФ), рецептор на факторот на раст добиен од тромбоцити (РФРТ) и васкуларен рецептор на факторот на раст (ВРФР),[33] исто така се вмешани во патогенезата на фиброза и ИПФ. И во двете фази III студии, нинтендиб го намали падот на функцијата на белите дробови за приближно 50% во текот на една година.[19] Тој бил одобрен од ФДА на САД во октомври 2014 година [34] и е овластен во Европа во јануари 2015 година.[35]
Пресадување на белите дробови[уреди | уреди извор]
Пресадувањето на белите дробови може да биде погодно за оние пациенти кои имаат физички квалификувани да поминат голема операција за пресадување. Кај ИПФ пациенти, се покажало дека пресадувањето на белите дробови го намалува ризикот од смрт за 75% во споредба со пациентите кои остануваат на списокот на чекање.[36] Од воведувањето на резултатот за алокација на белите дробови (РАБД), кој ги дава приоритетите на кандидатите за пресадување врз основа на веројатност за преживување, ИПФ стана најчеста индикација за пресадување на белите дробови во САД.[21]
Симптоматски пациенти со ИПФ помлади од 65 години и со индекс на телесна маса (БМИ) 26 кг / м 2 треба да се упати за пресадување на белите дробови, но нема јасни податоци за да се води точен тајминг за LTx. Иако се контроверзни, најновите податоци сугерираат дека билатералното пресадување на белите дробови е супериорна во однос на пресадувањето на единечни бели дробови кај пациенти со ИПФ.[37] Петгодишните стапки на преживување по пресадувањето на белите дробови во ИПФ се проценуваат на меѓу 50 и 56%.[3][38][39]
Палијативна нега[уреди | уреди извор]
Палијативната нега се фокусира на намалување на симптомите и подобрување на удобноста на пациентите, наместо на лекување на болеста. Ова може да вклучува третман на влошување на симптомите со употреба на хронични опиоиди за тешка диспнеја и кашлица. Понатаму, терапијата со кислород може да биде корисна за палијација на диспнеја кај пациенти со хипоксемија.
Палијативната нега исто така вклучува олеснување на физичко и емоционално страдање и психосоцијална поддршка за пациенти и старатели.[3] Со прогресија на болеста, пациентите може да доживеат страв, вознемиреност и депресија и затоа треба да се земе предвид психолошко советување. Во неодамнешната студија на амбулантски пациенти со ИЛД, вклучувајќи ИПФ, резултат на депресија, функционален статус (како што е оценето со тест на прошетка), како и белодробна функција, сите придонеле за сериозноста на диспнејата.[40]
Во избрани случаи на особено тешка диспнеја морфиум може да се земе предвид. Може да ја намали диспнејата, вознемиреноста и кашлицата без значително намалување на заситеноста на кислородот.[41]
Следење[уреди | уреди извор]
ИПФ често е погрешно дијагностицирана, барем додека физиолошките и/или податоците за слики не предложат присуство на ИЛД/ што доведува до одложување на пристапот до соодветна нега.[21] Ако се земе предвид дека ИПФ е болест со средно преживување од три години по дијагностицирање, треба да се разгледа рано упатување до центар со специфична експертиза за секој пациент со сомнителен или познат ИЛД. Врз основа на сложената диференцијална дијагностика, мултидисциплинарна дискусија помеѓу пулмолозите, радиолозите и патолозите искусни во дијагнозата на ИЛД е од најголема важност за точна дијагноза.[3]
По дијагностицирање на ИПФ и соодветниот избор на третман според симптоми и фаза на заболување, треба да се примени тесно следење. Поради високиот варијабилен тек на болеста, повисоката инциденца на компликации, како што е рак на белите дробови (до 25% од пациентите е забележана во ИПФ) рутинска проценка на секои 3 до 6 месеци, вклучително и спирометрија (телесна плетимографија), тестирање на капацитет на дифузија, Х-зраци на градите, проценка на диспнеја, квалитетот на животот, побарувачката за кислород е задолжителна.
Покрај тоа, зголемената свест за компликациите и вообичаените истовремени состојби кои честопати се поврзани со ИПФ, бара рутински проценка на комбинираност, повеќето од нив едноставно одразуваат истовремени заболувања на стареење и лекови со нивна интеракција и несакани ефекти.
Акутни егзацербации[уреди | уреди извор]
Акутните егзацербации на ИПФ (AE-ИПФ) се дефинираат како необјаснето влошување или развој на диспнеја во рок од 30 дена со нови радиолошки инфилтрати при абнормалност на ХРКТ, честопати надредени на позадина во согласност со УИП-шема. Годишната инциденца на AE-ИПФ е помеѓу 10 и 15% од сите пациенти. Прогнозата на AE-ИПФ е лоша, со смртност од 78% до 96%.[42] Треба да се исклучат други причини за AE-ИПФ, како што се белодробна емболија, конгестивна срцева слабост, пневмоторакс или инфекција. Белодробната инфекција треба да се отфрли од страна на ендотрахеален аспират или БАЛ.
Многу пациенти кои доживуваат акутно влошување, бараат третман на интензивна нега, особено кога респираторната слабост е поврзана со хемодинамичка нестабилност, значителни комбинирања или тешка хипоксемија.[43] Сепак, смртноста за време на хоспитализација е голема.[42] Механичката вентилација треба да се воведе само откако внимателно ќе ја измерите долгорочната прогноза на пациентот и, кога е можно, желбите на пациентот. Сепак, сегашните упатства обесхрабруваат употреба на механичка вентилација кај пациенти со респираторна слабост секундарна на ИПФ.[3]
Прогноза[уреди | уреди извор]

Клиничкиот тек на ИПФ може да биде непредвидлив.[3][44][45] Прогресијата на ИПФ е поврзана со проценетото средно време на преживување од 2 до 5 години по дијагностицирањето.[1] 5-годишното преживување за ИПФ се движи помеѓу 20–40%, стапка на смртност повисока од онаа на голем број на злоќудни заболувања, вклучувајќи карцином на дебелото црево, мултилозен миелом и рак на мочниот меур.
Неодамна се предложи повеќедимензионален индекс и систем за стагнирање за да се предвиди смртноста кај ИПФ.[46] Името на индексот е ГАП и се заснова на пол [Г], возраст [А] и две варијабили на физиологија на белите дробови [П] (ФВК, и ДЛ CO кои обично се мерат во клиничката пракса за да се предвиди смртност кај ИПФ). Откриено е дека највисоката фаза на ГАП (фаза III) е поврзана со ризик од смртност од 39% на 1 година. Овој модел е исто така оценет кај ИПФ и другите ИЛД и покажа добри перформанси при предвидување на смртност кај сите главни поттипови на ИЛД. Изработен е изменет ИЛД -ГАП индекс за апликација низ поттипови на ИЛД за да се обезбедат проценки за преживување специфични за болести.[47] Кај пациенти со ИПФ, вкупната смртност со стапка од 5 години е висока, но годишната стапка на смртност од сите причини кај пациенти со благо до умерено нарушување на белите дробови е релативно ниска. Ова е причината зошто промената во функцијата на белите дробови (ФВК) обично се мери во 1-годишни клинички испитувања на третмани со ИПФ отколку за преживување.[48]
Покрај клиничките и физиолошките параметри, за да се предвиди колку брзо може да напредуваат пациентите со ИПФ, генетските и молекуларните одлики се поврзани со смртност на ИПФ. На пример, се покажа дека ИПФ-пациенти кои имаат специфичен генотип во поликомфизмот на генот муцин МУК5Б (види погоре) доживуваат побавен пад на ФВК и значително подобрен опстанок.[49][50] Дури и ако таквите податоци се интересни од научна гледна точка, примената во клиничката рутина на прогностички модел заснован на специфични генотипови сè уште не е можна.
Епидемиологија[уреди | уреди извор]
Иако е ретка, ИПФ е најчестата форма на ИИП.[12] Преваленцијата на ИПФ е проценета помеѓу 14,0 и 42,7 на 100,000 лица врз основа на анализа на податоци за побарувања од здравствена заштита во САД, со варијации во зависност од дефинициите на случајот користени во овие анализи.[51][52] ИПФ е почеста кај мажите отколку кај жените и обично се дијагностицира кај луѓе постари од 50 години.[3]
Инциденцата на ИПФ е тешко да се утврди бидејќи униформни критериуми за дијагностицирање не се применуваат доследно.[3][51] Една неодамнешна студија од САД процени дека инциденцата на ИПФ е помеѓу 6,8 и 16,3 на 100 000 лица. Во 27 земји на Европската унија, голем број извори проценуваат зачестеност на 4,6–7,4 лица на 100 000 од населението,[53][54] сугерира дека приближно 30 000–35 000 нови пациенти ќе бидат дијагностицирани со ИПФ секоја година.[52][55]
Поради хетерогена дистрибуција на болеста низ европските земји, епидемиолошките податоци треба да се ажурираат преку регистар за широко распространетоста на растително ниво за ИЛД и ИПФ.
Други животни[уреди | уреди извор]
ИПФ е призната во неколку раси и на кучиња и мачки,[56] и најдобро се одликува во белите територии на Западен Хајленд.[57] Ветеринарни пациенти со состојба делат многу исти клинички знаци како и нивните човечки колеги, вклучувајќи прогресивна нетолеранција на вежбање, зголемена стапка на респираторност и евентуално вознемирување на дишењето.[58] Прогнозата е генерално лоша.
Истражување[уреди | уреди извор]
Во моментот се испитуваат голем број агенти во клиничкото испитување од II фаза за ИПФ, вклучувајќи ги и моноклоналните антитела симтузумаб, тралокинумаб, лебрикизумаб и ФГ-3019, антагонист на рецептор на лизофосфатидична киселина (БМС-986020). Студија во фаза 2 на СТЏ-100 е исто така во тек.[59] Овие молекули се насочени против неколку фактори на раст и цитокини за кои е познато дека играат улога во размножување, активирање, диференцијација или несоодветно преживување на фибробластите.
Истраги претходници на микро-РК микро-РНА кај глувци предизвикаа пресврт на индуцираната ИПФ. МРГ-201 во моментов се тестира заклучно со 2016 година, но сè уште не е кај пациенти со ИПФ и не се закажани човечки испитувања за употреба на ИПФ заклучно со јануари 2016 година.[60]
Терапиите на матични клетки за ИПФ се област на истражување.[61][62]
Наводи[уреди | уреди извор]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 „Idiopathic Pulmonary Fibrosis“. NHLBI. Посетено на 21 January 2018.
- ↑ 2,0 2,1 Raghu G, Rochwerg B, Zhang Y, Garcia CA, Azuma A, Behr J, и др. (July 2015). „An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline“. American Journal of Respiratory and Critical Care Medicine. 192 (2): e3–19. doi:10.1164/rccm.201506-1063ST. PMID 26177183.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 3,14 3,15 3,16 3,17 3,18 „An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management“. American Journal of Respiratory and Critical Care Medicine. 183 (6): 788–824. 2011. doi:10.1164/rccm.2009-040GL. PMC 5450933. PMID 21471066.
- ↑ 4,0 4,1 Ferri, Fred F. (2017). Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1 (англиски). Elsevier Health Sciences. стр. 691. ISBN 9780323529570.
- ↑ 5,0 5,1 „IPF: new insight on pathogenesis and treatment“. Allergy. 65 (5): 537–553. 2010. doi:10.1111/j.1398-9995.2009.02305.x. PMID 20121758.
- ↑ „Pathogenesis, current treatments and future directions for idiopathic pulmonary fibrosis“. Current Opinion in Pharmacology. 13 (3): 377–385. April 2013. doi:10.1016/j.coph.2013.03.015. PMC 3686907. PMID 23602652.
- ↑ „Idiopathic pulmonary fibrosis: new insights in its pathogenesis“. The International Journal of Biochemistry & Cell Biology. 34 (12): 1534–1538. 2002. doi:10.1016/s1357-2725(02)00091-2. PMID 12379275.
- ↑ „Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy“. Annals of Internal Medicine. 134 (2): 136–151. 2001. doi:10.7326/0003-4819-134-2-200101160-00015. PMID 11177318.
- ↑ „OMIM Entry - # 178500 - PULMONARY FIBROSIS, IDIOPATHIC; IPF“. Omim.org. Посетено на 7 June 2018.
- ↑ „Genetic susceptibility and pulmonary fibrosis“. Current Opinion in Pulmonary Medicine. 20 (5): 429–435. 2014. doi:10.1097/MCP.0000000000000074. PMC 4337021. PMID 25022318.
- ↑ „A novel dyskerin (DKC1) mutation is associated with familial interstitial pneumonia“. Chest. 146 (1): e1–7. Feb 6, 2014. doi:10.1378/chest.13-2224. PMC 4077414. PMID 24504062.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 „An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias“. American Journal of Respiratory and Critical Care Medicine. 188 (6): 733–48. September 2013. doi:10.1164/rccm.201308-1483ST. PMC 5803655. PMID 24032382.CS1-одржување: display-автори (link)
- ↑ „Prognostic implications of physiologic and radiographic changes in idiopathic interstitial pneumonia“. American Journal of Respiratory and Critical Care Medicine. 168 (5): 543–548. 2007. CiteSeerX 10.1.1.320.6411. doi:10.1164/rccm.200209-1112OC. PMID 12773329.
- ↑ „Significance of bronchoalveolar lavage for the diagnosis of idiopathic pulmonary fibrosis“. American Journal of Respiratory and Critical Care Medicine. 179 (11): 1043–1047. 2009. doi:10.1164/rccm.200808-1313oc. PMID 19246718.
- ↑ „Interpretative strategies for lung function tests“. European Respiratory Journal. 26 (5): 948–968. 2005. doi:10.1183/09031936.05.00035205. PMID 16264058.
- ↑ 16,0 16,1 „Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials“. The Lancet. 377 (9779): 1760–1769. 2011. doi:10.1016/S0140-6736(11)60405-4. PMID 21571362.
- ↑ „The clinical course of patients with idiopathic pulmonary fibrosis“. Annals of Internal Medicine. 142 (12 Pt 1): 963–7. June 2005. doi:10.7326/0003-4819-142-12_part_1-200506210-00005. PMID 15968010.
- ↑ 18,0 18,1 „A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis“ (PDF). New England Journal of Medicine. 370 (22): 2083–92. May 2014. doi:10.1056/NEJMoa1402582. PMID 24836312.CS1-одржување: display-автори (link)
- ↑ 19,0 19,1 „Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis“ (PDF). New England Journal of Medicine. 370 (22): 2071–82. May 2014. doi:10.1056/NEJMoa1402584. PMID 24836310.CS1-одржување: display-автори (link)
- ↑ „Increased exercise capacity in hypoxemic patients after long-term oxygen therapy“. Chest. 102 (2): 542–550. 1992. doi:10.1378/chest.102.2.542. PMID 1643945.
- ↑ 21,0 21,1 21,2 „Idiopathic pulmonary fibrosis: diagnostic pitfalls and therapeutic challenges“. Multidisciplinary Respiratory Medicine. 7 (1): 42. 2012. doi:10.1186/2049-6958-7-42. PMC 3537555. PMID 23146172.
- ↑ „Comprehensive care of the patient with idiopathic pulmonary fibrosis“. Current Opinion in Pulmonary Medicine. 17 (5): 348–54. September 2011. doi:10.1097/mcp.0b013e328349721b. PMID 21760508.
- ↑ „Pulmonary rehabilitation in patients with idiopathic pulmonary fibrosis--a review“. Respiration; International Review of Thoracic Diseases. 86 (2): 89–99. 2013. doi:10.1159/000354112. PMID 23942353.
- ↑ „Effect of interferon gamma-1b on survival in patients with idiopathic pulmonary fibrosis (INSPIRE): a multicentre, randomised, placebo-controlled trial“. Lancet. 374 (9685): 222–8. July 2009. doi:10.1016/S0140-6736(09)60551-1. PMID 19570573.CS1-одржување: display-автори (link)
- ↑ „BUILD-3: a randomized, controlled trial of bosentan in idiopathic pulmonary fibrosis“. American Journal of Respiratory and Critical Care Medicine. 184 (1): 92–9. July 2011. doi:10.1164/rccm.201011-1874OC. PMID 21474646.CS1-одржување: display-автори (link)
- ↑ „Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial“. Annals of Internal Medicine. 158 (9): 641–9. May 2013. doi:10.7326/0003-4819-158-9-201305070-00003. PMID 23648946.CS1-одржување: display-автори (link)
- ↑ „A placebo-controlled randomized trial of warfarin in idiopathic pulmonary fibrosis“. American Journal of Respiratory and Critical Care Medicine. 186 (1): 88–95. July 2012. doi:10.1164/rccm.201202-0314OC. PMC 3400994. PMID 22561965.CS1-одржување: display-автори (link)
- ↑ „Non-steroid agents for idiopathic pulmonary fibrosis“. Cochrane Database of Systematic Reviews (9): CD003134–non disponibile. 2010. doi:10.1002/14651858.CD003134.pub2. PMID 20824834.
|hdl-access=бара|hdl=(help) - ↑ „High-dose acetylcysteine in idiopathic pulmonary fibrosis“ (PDF). New England Journal of Medicine. 353 (21): 2229–2242. 2005. doi:10.1056/NEJMoa042976. PMID 16306520.
- ↑ „Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis“. New England Journal of Medicine. 366 (21): 1968–77. May 2012. doi:10.1056/NEJMoa1113354. PMC 3422642. PMID 22607134.
- ↑ „Commonly used three-drug regimen for idiopathic pulmonary fibrosis found harmful“. NIH. October 21, 2011. Посетено на 2013-04-11.
- ↑ The Idiopathic Pulmonary Fibrosis Clinical Research Network. (2014). „Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis“. New England Journal of Medicine. 370 (22): 2093–2102. doi:10.1056/nejmoa1401739. PMC 4116664. PMID 24836309.
- ↑ „BIBF 1120 Fact Sheet“ (PDF). Dl.groovygecko.net. Архивирано од изворникот (PDF) на 2016-03-03. Посетено на 2014-04-08.
- ↑ „FDA Approval Package for Nintedanib“ (PDF). www.accessdata.fda.gov. Посетено на 2019-01-07.
- ↑ „Ofev | European Medicines Agency“. www.ema.europa.eu. 2018-09-17. Посетено на 2019-01-07.
- ↑ „High lung allocation score is associated with increased morbidity and mortality following transplantation“. Chest. 137 (3): 651–657. 2010. doi:10.1378/chest.09-0319. PMC 2832864. PMID 19820072.
- ↑ „Lung transplantation for idiopathic pulmonary fibrosis“. The Annals of Thoracic Surgery. 84 (4): 1121–1128. 2007. doi:10.1016/j.athoracsur.2007.04.096. PMID 17888957.
- ↑ „Lung transplant in idiopathic pulmonary fibrosis“. Archives of Surgery. 146 (10): 1204–1209. 2011. doi:10.1001/archsurg.2011.239. PMID 22006881.
- ↑ „Lung transplantation in pulmonary fibrosis challenging early outcomes counter balanced by surprisingly good outcomes beyond 15 years“. Transplantation Proceedings. 41 (1): 289–291. 2009. doi:10.1016/j.transproceed.2008.10.042. PMID 19249537.
- ↑ „Depression and functional status are strongly associated with dyspnea in interstitial lung disease“. Chest. 139 (3): 609–616. 2011. doi:10.1378/chest.10-0608. PMID 20688924.
- ↑ „Low dose diamorphine reduces breathlessness without causing a fall in oxygen saturation in elderly patients with end-stage idiopathic pulmonary fibrosis“. Palliative Medicine. 19 (2): 128–130. 2005. doi:10.1191/0269216305pm998oa. PMID 15810751.
- ↑ 42,0 42,1 „Acute exacerbation of idiopathic pulmonary fibrosis: a systematic review“. European Journal of Internal Medicine. 19 (4): 227–235. 2008. doi:10.1016/j.ejim.2007.04.024. PMID 18471669.
- ↑ „Prognosis of patients with advanced idiopathic pulmonary fibrosis requiring mechanical ventilation for acute respiratory failure“. Chest. 120 (1): 213–219. 2001. doi:10.1378/chest.120.1.213. PMID 11451841.
- ↑ 44,0 44,1 „Prognostic significance of histopathologic subsets in idiopathic pulmonary fibrosis“ (PDF). American Journal of Respiratory and Critical Care Medicine. 157 (1): 199–203. 1998. doi:10.1164/ajrccm.157.1.9704130. PMID 9445300. Архивирано од изворникот (PDF) на 2019-02-27. Посетено на 2020-02-05.
- ↑ „Classification and natural history of the idiopathic interstitial pneumonias“. Proceedings of the American Thoracic Society. 3 (4): 285–92. June 2006. doi:10.1513/pats.200601-005TK. PMC 2658683. PMID 16738191.
- ↑ „A multidimensional index and staging system for idiopathic pulmonary fibrosis“. Annals of Internal Medicine. 156 (10): 684–691. 2012. CiteSeerX 10.1.1.691.4472. doi:10.7326/0003-4819-156-10-201205150-00004. PMID 22586007.
- ↑ „Predicting Survival Across Chronic Interstitial Lung Disease: The ILD-GAP Model“. Chest. 145 (4): 723–728. 2014. doi:10.1378/chest.13-1474. PMID 24114524.
- ↑ „All-cause mortality rate in patients with idiopathic pulmonary fibrosis. Implications for the design and execution of clinical trials“. American Journal of Respiratory and Critical Care Medicine. 189 (7): 825–31. April 2014. doi:10.1164/rccm.201311-1951OC. PMID 24476390.
|hdl-access=бара|hdl=(help) - ↑ „Association between the MUC5B promoter polymorphism and survival in patients with idiopathic pulmonary fibrosis“. JAMA. 309 (21): 2232–2239. 2013. doi:10.1001/jama.2013.5827. PMC 4545271. PMID 23695349.
- ↑ „Mucin 5B promoter polymorphism is associated with idiopathic pulmonary fibrosis but not with development of lung fibrosis in systemic sclerosis or sarcoidosis“. Thorax. 68 (5): 436–441. 2013. doi:10.1136/thoraxjnl-2012-201786. PMID 23321605.
- ↑ 51,0 51,1 „Incidence and prevalence of idiopathic pulmonary fibrosis“. American Journal of Respiratory and Critical Care Medicine. 174 (7): 810–816. 2006. doi:10.1164/rccm.200602-163oc. PMID 16809633.
- ↑ 52,0 52,1 Pulmonary Fibrosis Foundation. "Prevalence and Incidence". Pulmonaryfibrosis.org. Retrieved 2013-04-11
- ↑ „Incidence and mortality of idiopathic pulmonary fibrosis and sarcoidosis in the UK“. Thorax. 61 (11): 980–985. 2006. doi:10.1136/thx.2006.062836. PMC 2121155. PMID 16844727.
- ↑ „Eurostat News Release. European demography. 110/2010. 27 July 2010“ (PDF). Epp.eurostat.ec.europa.eu. Посетено на 7 June 2018.
- ↑ „Identification of spontaneous feline idiopathic pulmonary fibrosis: morphology and ultrastructural evidence for a type II pneumocyte defect“. Chest. 125 (6): 2278–2288. 2004. doi:10.1378/chest.125.6.2278. PMID 15189952.
- ↑ „Chronic idiopathic pulmonary fibrosis in a West Highland white terrier“. The Canadian Veterinary Journal. 43 (9): 703–705. 2002. PMC 339552. PMID 12240528.
- ↑ „AKC Canine Health Foundation“. Akcchf.org. Посетено на 7 June 2018.
- ↑ „Active Clinical Trials and Investigational Research in IPF“. Архивирано од изворникот на 2014-09-04. Посетено на 2014-09-04.
- ↑ „Research Demonstrates Reversal Of Pulmonary Fibrosis With miRagen Therapeutics Synthetic microRNA-29 Mimic (promiR-29)“. Pulmonaryfibrosisnews.com. 2014-09-23. Посетено на 8 June 2018.
- ↑ „Stem Cell and Idiopathic Pulmonary Fibrosis: Mechanisms and Treatment“. Current Stem Cell Research & Therapy. 10 (6): 466–76. 2015. doi:10.2174/1574888X10666150519092639. PMID 25986617.
- ↑ „Stem cell therapy for lung fibrosis conditions“. Sciencedaily.com. Посетено на 8 June 2018.
Надворешни врски[уреди | уреди извор]
| Класификација | |
|---|---|
| Надворешни извори |
- Идиопатска пулмонална фиброза (ИПФ) на Curlie (англиски)
