Арил халид
Во органската хемија, арил халид (исто така познат како халоарен) е ароматично соединение во кое еден или повеќе атоми на водород кои се директно поврзани со ароматичен прстен се заменуваат со халид . Халоаренот се разликува од халоалканите во методите на подготовка и својствата. Оваа класаса на соединенија е широка и има многу деривати и примени. Најважните членови на арил халидите се се арил хлоридите.
Подготовка[уреди | уреди извор]
Двата главни методи на потготовка на арил халидите се директна халогенација и добивање од соли на дијазониум.[1]
Директна халогенација[уреди | уреди извор]
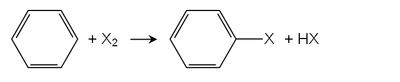
При халогенацијата на Friedel-Crafts, како катализатори се користат т.н "Луис" киселини. Се користат многу метални хлориди, како железо(III) хлорид или алуминиум хлорид . Најважниот арил халид, хлоробензенот, се произведува по овој пат. Монохлорирањето на бензенот е секогаш придружено со формирање на деривати на дихлоробензен.[2]
Арените со групи кои даруваат електрони реагираат со халогени дури и во отсуство на Луис киселини. На пример, фенолите и анилините бргу реагираат со хлор и бром вода и проидведуваат халогенирани производи.
Реакциите на Сендмаер, Балц-Шиман и Гатерман[уреди | уреди извор]
Вториот главен пат е реакцијата на Сендмаер. Анилините (арил амини) се претвораат во нивните дијазониумски соли користејќи азотеста киселина . На пример, бакар(I) хлоридот ги претвора солите на дијазониум во арил хлорид. При сличната реакција на Шиман, како донор на флуорид се јавува анјонот на тетрафлуороборат. Може да се користи и реакцијата на Гатерман. При оваа реакција доаѓа до претворање на солта на дијазониум во хлоробензен или бромобензен. Притоа се користи бакар во прав наместо бакар хлорид или бакар бромид и при реакцијата задолжително е присуство на HCl и HBr соодветно.
Арил халиди во природата[уреди | уреди извор]
Арил халидите се наоѓаат нашироко во природата. Најчесто се произведени од морски организми кои го користат хлоридот и бромидот во океанските води. Хлорирани и бромирани ароматични соединенија се исто така многубројни во природата. На пример, се сретнуваат деривати на тирозин, триптофан и разни деривати на пирол. Некои од овие природни арил халиди покажуваат корисни лековити својства.[3][4]

Структурни трендови[уреди | уреди извор]
Растојанијата C-X кај арил халидите го следат очекуваниот тренд. Овие растојанија за флуоробензен, хлоробензен, бромобензен и метил 4-јодобензоат се 135,6 (4), 173,90 (23), 189,8 (1) и 209,9 pm, соодветно.[5]
Замена[уреди | уреди извор]
За разлика од типичните алкил халиди, арил халидите обично не учествуваат во конвенционалните реакции на супституција. Арил-халидите кои содржат функционални групи кои привлекуваат електрони во орто и пара позиции можат да подлежат на <sub id="mwRQ">SN</sub> Ar реакции. На пример, 2,4-динитрохлоробензен реагира во основен раствор и дава фенол.
Бензин[уреди | уреди извор]
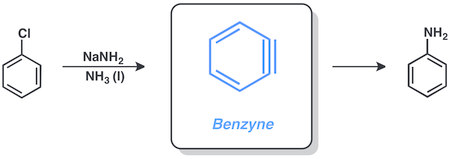
Арил халидите често реагираат преку посредство на бензини. Хлоробензенот и натриум амид реагираат во течен амонијак и на овој начин даваат анилин.
Формирање на органометален реагенс[уреди | уреди извор]
Арил халидите реагираат со метали, главно литиум или магнезиум, за да дадат повеќе органометални деривати кои функционираат како извори на арил анјони. Со реакција на размена на метал-халоген, арил халидите се претвораат во соединенија на арил литиум. Илустративно е подготовката на фенил литиум од бромобензен со употреба на бутил литиум (BuLi):
- C 6 H 5 Br + BuLi → C 6 H 5 Li + BuBr
Други реакции[уреди | уреди извор]
Халидите може да се поместат од силни нуклеофили преку реакции кои вклучуваат радикални анјони. Алтернативно, арил халидите, особено бромидите и јодидите, подлежат на оксидативна адиција, и затоа се предмет на реакции од типот на аминација Бухвалд-Хартвиг.
Хлоробензенот некогаш бил претходник на фенолот. При високи температури, арилните групи реагираат со амонијак и даваат анилини.[2]
Биоразградување[уреди | уреди извор]
Rhodococcus phenolicus е бактерија која го разградува дихлоробензенот како единствен извор на јаглерод.[6]
Апликации[уреди | уреди извор]
Арил халидите кои се произведуваат во најголем обем се хлоробензенот и изомерите на дихлоробензенот. Хлоробензен во минатото бил користен како растворувач за дисперзирање на хербицидот Ласо. Производството на арил хлориди (исто така и нафтил деривати) опаѓа од 1980-тите поради еколошките грижи.[2] Трифенилфосфинот се произведува од хлоробензен:
- 3 C 6 H 5 Cl + PCl 3 + 6 Na → P (C 6 H 5 ) 3 + 6 NaCl
Арил бромидите се широко користени како огноотпорни сретства. Најистакнат член е тетрабромобисфенол-А, кој се подготвува со директно бромирање на дифенолот.[7]
Наводи[уреди | уреди извор]
- ↑ Boyd, Robert W.; Morrison, Robert (1992). Organic chemistry. Englewood Cliffs, N.J: Prentice Hall. стр. 947. ISBN 978-0-13-643669-0.
- ↑ 2,0 2,1 2,2 Beck, U.; Löser, E. (2011). „Chlorinated Benzenes and Other Nucleus-Chlorinated Aromatic Hydrocarbons“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.o06_o03. ISBN 978-3527306732.
- ↑ Fujimori, Danica Galonić; Walsh, Christopher T. (2007). „What's new in enzymatic halogenations“. Current Opinion in Chemical Biology. 11 (5): 553–60. doi:10.1016/j.cbpa.2007.08.002. PMC 2151916. PMID 17881282.
- ↑ Gribble, Gordon W. (2004). „Natural Organohalogens: A New Frontier for Medicinal Agents?“. Journal of Chemical Education. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021/ed081p1441.
- ↑ Oberhammer, Heinz (2009). „The Structural Chemistry of Carbon-Halogen Bonds“. PATai's Chemistry of Functional Groups. doi:10.1002/9780470682531.pat0002. ISBN 978-0-470-68253-1.
- ↑ Rehfuss, Marc; Urban, James (2005). „Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources“. Systematic and Applied Microbiology. 28 (8): 695–701. doi:10.1016/j.syapm.2005.05.011. PMID 16261859.
- ↑ Ioffe, D.; Kampf, A. (2002). „Bromine, Organic Compounds“. Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002/0471238961.0218151325150606.a01. ISBN 978-0471238966.
